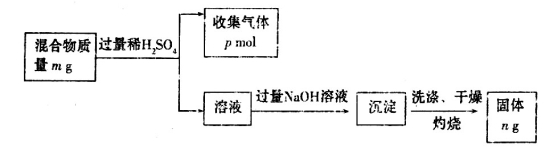
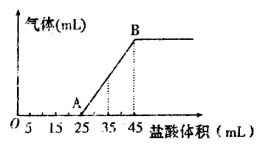
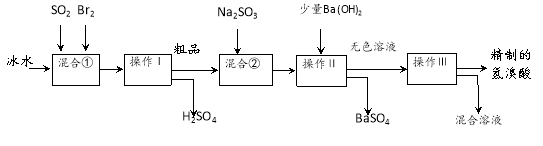
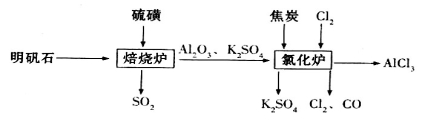
-
化学与资源、环境、生活关系密切,下列说法错误的是
A.维生素C具有还原性,在人体内起抗氧化作用
B.新型氢动力计程车可以降低PM2.5的排放,减少大气污染
C.碘是人体必需微量元素,所以要多吃富含高碘酸的食物
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱溶液会“断路”
难度: 中等查看答案及解析
-
下列说法正确的是
A.水玻璃、漂白粉、胆矾均为混合物
B.生成盐和水的反应一定是中和反应
C.NaOH、MgC12、NaC1O、NH4C1均为含共价键的离子化合物
D.煤经过气化或液化两类化学变化,可变为清洁能源
难度: 中等查看答案及解析
-
下列有关结构和性质的说法正确的是
A.元素铯的两种核素
多4个质子
B.P、S、C1得电子能力和最高价氧化物对应水化物的酸性均依次增强
C.元素原子的最外层电子数越多,越容易得电子
D.从上到下,第VIIA族元素氢化物的热稳定性和还原性均依次减弱
难度: 中等查看答案及解析
-
下列叙述正确的是
A.液溴易挥发,在存放液溴的试剂瓶中应加水封
B.不慎将硫酸沾在皮肤上,立刻用干布擦净,然后用氢氧化钠溶液冲洗
C.实验室配制一定物质的量浓度的溶液,定容时仰视刻度线,所配制溶液浓度偏大
D.某溶液中加入BaC12溶液,产生了不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+
难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应:
。则下列判断错误的是.
A.该反应能在瞬间完成,并产生大量气体
B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol
C.该反应中的氧化剂为KNO3
D.被氧化和被还原的N原子的物质的量之比为15:1
难度: 中等查看答案及解析
-
关于元素及其化合物,下列说法正确的是
A.C12具有氧化性,故可以做漂白剂
B.Na、A1、Fe三种单质在一定条件下与水反应都生成H2和对应的碱
C.将浓硝酸、浓硫酸露置在空气中,两溶液的质量均增大、浓度均减小
D.将表面有铜绿
的铜器放入盐酸中浸泡,可除去铜绿
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.
B.用FeC13溶液腐蚀电路板:
C.向
溶液中通入过量
D. 用食醋除去水瓶中的水垢:
难度: 中等查看答案及解析
-
C、N、S都是重要的非金属元素,下列说法正确的是
A.三者对应的氧化物均为酸性氧化物
B.实验室可用NaOH溶液处理
废气
C.三者的单质直接与氧气反应都能生成两种氧化物
D.CO2、NO2、SO2都能与H2O反应,其反应原理相同
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列叙述正确的是
A.
与足量Fe反应转移电子数一定为3NA
B.标准状况下,22.4L NH3中含有共价键的数目为NA
C.1.0L
的
水溶液中含有的氧原子数为3NA
D.4.6g Na完全转化成
的混合物,混合物中阴离子总数为0.1NA
难度: 中等查看答案及解析
-
下列叙述正确的是
A.等质量的铝分别与足量氢氧化钠溶液和稀硝酸反应,放出的氢气一样多
B.将SO2通入过量
溶液可生成
沉淀
C.自来水厂常用明矾对水进行杀菌、消毒
D.将稀硫酸滴加到Fe(NO3)2溶液中无明显现象
难度: 中等查看答案及解析
-
下列装置或操作能达到相应实验目的的是
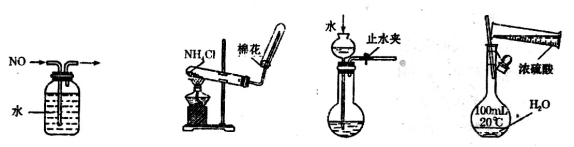
A.排水集气法收集NO B.实验室制取氨气 C.检查装置气密性 D.配制稀硫酸
难度: 中等查看答案及解析
-
下列叙述I和II均正确,且有因果关系的是

难度: 中等查看答案及解析
-
下列各组微粒在指定环境中一定可大量共存的是
A.
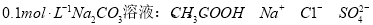
B.常温下,
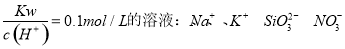
C.投入
固体能产生气体的溶液:
D.pH=1的溶液中:
难度: 中等查看答案及解析
-
仅用下表提供的实验器材(夹持仪器和试剂任选),不能完成相应实验的是
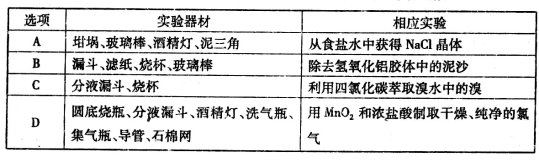
难度: 中等查看答案及解析
-
下列过程最终无沉淀产生的是( )
A.过量氨气通入Al2(SO4)3溶液 B.CO2通入CaCl2溶液
C.少量SO2通入BaCl2溶液后再通入过量Cl2 D.过量CO2通入Na2SiO3溶液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.常温下,2. 7g铝片投入足量的浓硫酸中,铝失去的电子数为0. 3NA.
B.1L 1mol/L的盐酸溶液中,所含氯化氢分子数为NA
C.标准状况下,11.2L四氯化碳所含分子数为0.5 NA
D.在铜与硫的反应中,1mol铜完全反应失去的电子数为 NA
难度: 中等查看答案及解析