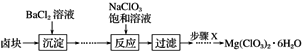
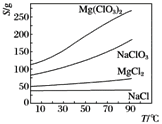
-
某溶液中可能含有 Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+、K+。取该溶液100mL,加入过量 NaOH 溶液,加热,得到 0.02mol 气体,同时产生红褐色沉淀;过滤、洗涤灼烧,得 1.6g 固体,向上述溶液 中加足量 BaCl2溶液,得到 4.66g 不溶于盐酸的沉淀,由此可知原溶液中
A. 至少存在 5 种离子
B. Cl-一定存在,且 c(Cl-) ≥ 0.4mol·L-1
C. SO42-、NH4+一定存在,Cl- 可能不存在
D. CO32-、Al3+一定不存在,K+可能存在
难度: 困难查看答案及解析
-
下列有关物质分类或归类中,正确的是
①混合物:盐酸、漂白粉、氯水、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、生石膏、冰醋酸、氯化银
④同素异形体:C60、C70、金刚石、石墨
A. ①③ B. ②③ C. ③④ D. ④
难度: 简单查看答案及解析
-
我们生活在千变万化的物质世界里。下列过程或变化中,没有发生氧化还原反应的是( )
A. iPhone 8手机电池放电 B. 铁制品的镀铜过程
C. 爆竹爆炸 D. 利用焰色反应检验K+
难度: 简单查看答案及解析
-
下列有关物质分类或归纳的说法中,正确的是( )
A. SO2、NO2和CO2都是污染性气体
B. 熟石灰、铝热剂、盐酸都是混合物
C. 煤的干馏、海水中提取碘的过程都包括化学变化
D. A12O3、Cl2、CuSO4在熔融状态或溶于水时均能导电,都属电解质
难度: 简单查看答案及解析
-
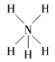
下列有关化学用语正确的是 ( )
A. NaOH的电子式:
B. I4O9(碘酸碘)中碘的化合价为+1、+5
C. NH5的结构与NH4Cl相似,NH5的结构式为
D. 离子结构示意图
可以表示35Cl-,也可以表示37Cl-
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 发酵粉中主要含有碳酸钠,能使焙制出的糕点疏松多孔
B. 可用淀粉溶液来检测食盐中是否含碘
C. 日常生活中常用75%的乙醇溶液来杀菌消毒
D. 医院中常用碳酸钡作为内脏造影剂
难度: 简单查看答案及解析
-
“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质 ①是溶液 ②是胶体 ③能产生丁达尔效应 ④不能透过滤纸 ⑤能透过滤纸 ⑥静置后会析出黑色沉淀
A. ①④⑤ B. ②③④ C. ②③⑤ D. ①③④⑥
难度: 简单查看答案及解析
-
关于Na2O2的叙述正确的是(NA为阿伏加德罗常数的值) ( )
A. 7.8 g Na2O2含有的共价键数为0.2NA
B. 0.2mol Na与O2在一定条件下反应转移的电子数为0.2NA
C. 质量分数为46%的乙醇水溶液中氧原子数为 NA
D. 标准状况下,22.4 L苯含有NA个C6H6分子
难度: 简单查看答案及解析
-
在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液的浓度偏高的是
A. 用量筒量取浓盐酸时俯视量筒刻度进行读数
B. 溶解搅拌时有液体飞溅
C. 定容时俯视容量瓶瓶颈刻度线
D. 摇匀后见液面下降,再加水至刻度线
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 在氧化还原反应中,还原剂和氧化剂一定是不同物质
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态转变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
难度: 简单查看答案及解析
-
如图所示,若锥形瓶内是水,分液漏斗内的液体也是水,向烧杯内滴加水时,发现U形管内液体慢慢右移,恢复到原温度后液面左边与右边基本相平,则烧杯内的物质是

A. 过氧化钠 B. 氧化钠 C. 钠 D. 钾
难度: 中等查看答案及解析
-
R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z =X +Z2+ ;Y + Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合
A. R2+>X2+>Z2+>Y2+ B. X2+>R2+>Y2+>Z2+
C. Y2+>Z2+>R2+>X2+ D. Z2+>X2+>R2+>Y2+
难度: 中等查看答案及解析
-
某同学在实验室进行了如图所示的实验,下列说法中错误的是

A. 利用过滤的方法,可将Z 中固体与液体分离
B. X、Z烧杯中分散质相同
C. Y 中反应的离子方程式为3CaCO3+2Fe3++3H2O=2Fe(OH)3(胶体)+3CO2↑+3Ca2+
D. Z 中能产生丁达尔效应
难度: 困难查看答案及解析
-
两种大气污染物NO2和SO2在一定条件下可以发生如下反应:NO2+SO2===NO+SO3,在体积为V L的密闭容器中通入3 mol NO2和5 mol SO2,反应后容器内氮原子和氧原子个数比为 ( )
A. 3∶10 B. 16∶3 C. 3∶16 D. 5∶16
难度: 中等查看答案及解析
-
在下列各组溶液中,离子一定能大量共存的是
A. 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、I-
B. 常温下,pH=1的溶液:Fe3+、Na+、NO3-、SO42-
C. 滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO42-
D. 含0.1mol/LNH4Al(SO4)2·12H2O的溶液:K+、Ca2+、NO3-、OH-
难度: 中等查看答案及解析
-
下列各反应对应的离子方程式正确的是 ( )
A. 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2OH-+2HCO===CaCO3↓+CO
+2H2O
B. 向含0.1 mol NaOH和0.1 mol Na2CO3的溶液中加入1 L 0.2 mol·L-1稀盐酸:OH-+CO
+3H+===CO2↑+2H2O
C. 硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO
+Ba2++OH-===BaSO4↓+H2O
D. 向100 mL 0.12 mol·L-1的Ba(OH)2溶液中通入0.02 mol CO2:Ba2++3OH-+2CO2===HCO+BaCO3↓+H2O
难度: 中等查看答案及解析
-
工业上以铬铁矿(主要成分为FeO•Cr2O3)、碳酸钠、氧气、和硫酸为原料生产重铬酸钠(Na2Cr2O7•2H2O),其主要反应为:
(1)4FeO•Cr2O3+8Na2CO3+7O2
8Na2CrO4+2Fe2O3+8CO2
(2)2Na2CrO4+H2SO4
Na2SO4+Na2Cr2O7+H2O
下列说法正确的是( )
A. 反应(1)和(2)均为氧化还原反应
B. 反应(1)的氧化剂是O2,还原剂是FeO•Cr2O3
C. 高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4
D. 反应(1)中每生成1molNa2CrO4时电子转移3mol
难度: 中等查看答案及解析
-
如表所示,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项
陈述Ⅰ
陈述Ⅱ
判断
A
碳酸钠溶液可用于治疗胃病
Na2CO3可与盐酸反应
Ⅰ对,Ⅱ对,有
B
向滴有酚酞的水溶液中加入Na2O2变红色
Na2O2与水反应生成氢氧化钠
Ⅰ对,Ⅱ错,无
C
金属钠具有强还原性
高压钠灯发出透雾性强的黄光
Ⅰ对,Ⅱ对,有
D
过氧化钠可为航天员供氧
Na2O2能与CO2和H2O反应生成O2
Ⅰ对,Ⅱ对,有
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
3 g镁铝合金与100 mL稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐17.4 g,则原硫酸的物质的量浓度为( )
A. 1 mol·L-1 B. 1.5 mol·L-1
C. 2 mol·L-1 D. 2.5 mol·L-1
难度: 中等查看答案及解析
-
向某NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)(3)(4)图中分别有OA<AB,OA=AB,OA>AB,则下列分析与判断不正确的是( )

A. M中只有一种溶质的有(1)和(3)
B. M中有两种溶质的有(2)和(4)
C. (2)图显示M中c(NaHCO3)<c(Na2CO3)
D. (4)图显示M中的溶质为NaOH和Na2CO3
难度: 困难查看答案及解析
-
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( )

A. a点对应的溶液中:Na+、OH-、SO42—、NO3— B. b点对应的溶液中:K+、Ca2+、MnO4—、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3—、Cl- D. d点对应的溶液中:F-、NO3—、Fe2+、Ag+
难度: 困难查看答案及解析
-
向甲溶液中缓慢滴加乙溶液,反应生成沉淀的质量如图所示,其中符合图像的一组是( )
选项
甲
乙

A
AlCl3、Mg(NO3)2、HNO3
NaOH
B
Na2CO3、NH4HCO3、Na2SO4
Ba(OH)2
C
NH4NO3、Al(NO3)3、Fe(NO3)3、HCl
NaOH
D
NaAlO2、氨水、NaOH
H2SO4
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol·L-1的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是( )

A. 原合金质量为0.92 g B. 产生氢气的体积为896 mL(标准状况下)
C. 图中m的值为1.56 D. 图中V2的值为60
难度: 中等查看答案及解析