-
下列物质在水溶液中的电离方程式书写正确的是
A.CH3COOH
H++CH3COO-
B.NaHSO4=Na++HSO4-
C.H3PO4
3H++PO43-
D.NaHCO3
Na++HCO3-
难度: 中等查看答案及解析
-
分别在pH=1的酸和pH=14的NaOH溶液中加入足量的铝,放出H2的量前者多,其原因可能是
①两溶液的体积相同,酸是多元强酸
②两溶液的体积相同,酸是一元弱酸
③酸溶液的体积大于NaOH溶液的体积
④酸是强酸,浓度比NaOH溶液的大
A.①② B.② C.②③ D.④
难度: 困难查看答案及解析
-
甲酸是一种一元有机酸。下列性质可以证明它是弱电解质的是
A.甲酸能与水以任意比互溶
B.1 mol/L甲酸溶液的pH约为2
C.10 mLl1mol/L甲酸恰好与10 mL 1mol/L NaOH溶液完全反应
D.甲酸溶液的导电性比盐酸溶液的弱
难度: 简单查看答案及解析
-
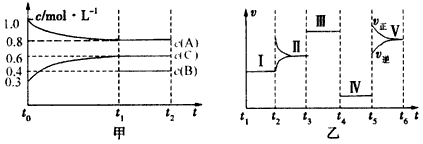
把0.05molNaOH固体分别加入到下列100ml液体中,导电能力变化较大的是
A.0.5mol·L-1MgSO4溶液 B.0.5mol·L-1盐酸
C.0.5mol·L-1的CH3COOH溶液 D.0.5mol·L-1NH4Cl溶液
难度: 简单查看答案及解析
-
室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是
A.加适量的醋酸钠晶体后,两溶液的pH均增大
B.使温度都升高20℃后,两溶液的pH均不变
C.加水稀释2倍后,两溶液的pH均减小
D.加足量的锌充分反应后,两溶液中产生的氢气一样多
难度: 中等查看答案及解析
-
室温下,往0.001mol·L-1的氨水中滴入几滴酚酞试液时,溶液呈现粉红色。现采取下列措施,其中能使滴有酚酞的氨水溶液颜色变浅的是
A.往溶液中滴入0.2mol·L-1的氨水
B.往溶液中加入NH4Cl晶体
C.往溶液中加入CH3COONa固体
D.往溶液中加入NaOH固体
难度: 简单查看答案及解析
-
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%。现取20 mL pH=3的 CH3COOH溶液,加入0.2 mol·L-1的氨水,测得溶液导电性变化如右图,则加入氨水前CH3COOH的电离度为
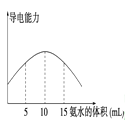
A.0.5% B.1.5% C.0.1% D.1%
难度: 中等查看答案及解析
-
25℃时,在等体积的①pH=0的H2SO4溶液、②0.05 mol·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.1∶10∶1010∶109 B.1∶5∶5×109∶5×108
C.1∶20∶1010∶109 D.1∶10∶104∶109
难度: 中等查看答案及解析
-
已知:25℃时,有关弱酸的电离平衡常数,下列选项中正确的是
弱酸
H2C2O4
CH3COOH
HCN
H2CO3
电离常数Ki
Ki1=5.9×l0-2
Ki2=6.4×l0-5
1.8×l0-5
4.9×l0-10
Ki1=4.3×l0-7
Ki2=5.6×l0-11
A.等物质的量浓度的溶液pH关系:NaHCO3>NaCN>CH3COONa>NaHC2O4
B.反应NaHC2O4+NaHCO3→Na2C2O4+H2O+CO2↑能发生
C.等体积等物质的量浓度的溶液中离子总数:NaCN>CH3COONa
D.Na2CO3溶液中2c(Na+)=c(CO32-)+c(HCO3-)+c( H2CO3)
难度: 中等查看答案及解析
-
某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是


A.a、c两点溶液的导电能力相同
B.b点溶液中c(H+)+c(NH3·H2O)=c(OH-)
C.用等浓度的NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb>Vc
D.a、b、c三点溶液中水的电离程度a>b>c
难度: 困难查看答案及解析
-
下列反应不属于水解反应或水解方程式不正确的是
①HCl+H2O
H3O++Cl-
②Na2CO3+H2O
H2CO3+2NaOH
③Na2CO3+2H2O
H2CO3+2NaOH
④碳酸氢钠溶液:HCO3-+H2O=CO32-+H3O+
⑤NH4Cl溶于D2O中:NH4++D2O
NH3·D2O+H+
A.①②③④ B.①②③ C.②③⑤ D.全部
难度: 中等查看答案及解析
-
室温下某无色透明液体中由水电离出的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42-
B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、SO42-、K+
D.SiO32-、OH-、SO32-、Na+、Cl-
难度: 中等查看答案及解析
-
下列公式哪一个能用来精确地计算任意浓度的盐酸中的氢离子浓度c(H+)(Kw为水的离子积常数)
A.c(H+)=c(HCl) B.c(H+)=c(HCl)+KW/c(H+)
C.c(H+)=c(HCl)+KW D.c(H+)=c(HCl)-KW/c(H+)
难度: 简单查看答案及解析
-
常温下1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,该碱溶液的pH为
A.9.0 B.9.5 C.10.5 D.11.5
难度: 简单查看答案及解析
-
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是
A.HN3水溶液中微粒浓度大小顺序为c(HN3)>c(H+)>c(N3-)>c(OH-)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+)
D.N3-与CO2含相等电子数
难度: 中等查看答案及解析
-
下列溶液在空气中加热蒸干并灼烧后,能得到相应溶质固体的是
A.FeCl3 B.KHCO3 C.Fe2(SO4)3 D.FeSO4
难度: 简单查看答案及解析
-
配制下列溶液时常需加入少量括号内的物质,其中不是为了抑制离子水解的是
A.FeSO4(Fe) B.SnCl2(HCl) C.FeCl3(HCl) D.NaAlO2(NaOH)
难度: 简单查看答案及解析
-
无色透明溶液中能大量共存的离子组是
A.Na+、Al3+、HCO3-、NO3- B.AlO2-、Cl-、Mg2+、K+
C.NH4+、Na+、CH3COO-、NO3- D.Na+、NO3-、ClO-、I-
难度: 中等查看答案及解析
-
为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入一种试剂,该试剂是
A.NaOH B.Na2CO3 C.氨水 D.MgO
难度: 简单查看答案及解析
-
一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O
CH3COOH+OH-,下列说法正确的是
A.加入少量NaOH固体,c(CH3COO-)增大
B.加入少量FeCl3固体,c(CH3 COO-)增大
C.稀释溶液,溶液的pH增大
D.加入适量醋酸得到的酸性混合溶液:c( Na+) >c(CH3COO-)>c(H+) >c( OH-)
难度: 简单查看答案及解析
-
下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是
A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳泡沫
C.厨房中常用碳酸钠溶液洗涤餐具上的油污
D.可用碳酸钠与醋酸制取少量二氧化碳
难度: 中等查看答案及解析
-
已知,常温下某浓度NaHSO3稀溶液的pH<7,则该稀溶液中下列粒子关系正确的是
A.c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-)
B.c(Na+)>c(HSO3-)+c(SO32-)
C.c(Na+)+c(H+)=2c(SO32-)
D.c(Na+)+c(H+)=c(HSO3-)+c(OH-)
难度: 中等查看答案及解析
-
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂。下列操作中可能使测定结果偏低的是
A.酸式滴定管在装酸液前未用标准盐酸润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色的变化由黄色变为橙色时,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
难度: 中等查看答案及解析
-
中和滴定是一种操作简单、准确度高的定量分析方法,实际工作中也可利用物质间的氧化还原反应、沉淀反应进行类似的滴定分析,这些滴定分析均需要通过指示剂来确定滴定终点,下列对几种具体的滴定分析(待测液置于锥形瓶内)中所用指示剂及滴定终点时的溶液颜色的判断不正确的是
A.用标准酸性KMnO4溶液滴定Na2SO3溶液以测量其浓度:KMnO4--紫红色
B.利用“Ag++SCN-═AgSCN↓”原理,可用标准KSCN溶液测量AgNO3溶液浓度:Fe(NO3)3--红色
C.利用“2Fe3++2I-═I2+2Fe2+”,用FeCl3溶液测量KI样品中KI的百分含量:淀粉--蓝色
D.利用OH-+H+═H2O来测量某盐酸溶液的浓度时:酚酞--浅红色
难度: 中等查看答案及解析
-
①用pH试纸测得氯水的pH为2
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥实验室配制氯化铁溶液时,可以先将氯化铁溶解在盐酸中,再配制到所需的浓度
A. ②④⑥ B. ②③⑥ C. ①②④ D. ②③④⑤⑥
难度: 中等查看答案及解析
-
下列叙述正确的是
A.pH=3的酸溶液稀释100倍后,pH=5
B.在相同温度下,pH =3的溶液和pH =5的溶液相比,前者氢离子浓度是后者的100倍
C.相同温度和相同浓度的钾盐溶液中,酸式盐的pH 一定小于正盐的pH
D.碳酸钠溶液在室温时pH大于60℃时的pH
难度: 简单查看答案及解析
-
将0.10mol/L的AlCl3溶液10mL与0.10mol/L的KOH溶液40mL充分混和,所得溶液中各种微粒的物质的量浓度关系正确的是
A.c(K+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+)
B.c(K+)>c(Cl-)>c(AlO2-)>c(H+)>c(OH-)
C.c(Cl-)>c (K+)>c(OH-)>c(AlO2-)>c(H+)
D.c(Cl-)>c((K+)>c(AlO2-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
常温下,一定量的醋酸与氢氧化钠溶液发生中和反应。下列说法正确的是
A.当溶液中c(CH3COO-)=c(Na+)时,醋酸与氢氧化钠恰好完全反应
B.当溶液中c(CH3COO-)=c(Na+)时.一定是氢氧化钠过量
C.当溶液中c(CH3COO-)=c(Na+)>c(H+)=c(OH-)时,一定是醋酸过量
D.当溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量
难度: 中等查看答案及解析
-
今有室温下四种溶液,有关叙述不正确的是
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸
盐酸
A.①②中分别加入适量的醋酸钠晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH①>②>④>③
C.①④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va:Vb=11:9
难度: 中等查看答案及解析
-
常温下,用0.1000mol/LNaOH溶液滴定20.00mL0.1000mol/LCH3COOH溶液所得滴定曲线如右图。下列说法正确的是
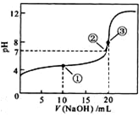
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
难度: 困难查看答案及解析