-
将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+28HNO3═9Fe(NO3)x+NO↑+14H2O下列判断合理的是( )
A.Fe(NO3)x中的x为2
B.反应中每还原0.4mol氧化剂,就有1.2mol电子转移
C.稀HNO3在反应中只表现氧化性
D.磁性氧化铁中的所有铁元素全部被氧化难度: 中等查看答案及解析
-
下列各项表述正确的是( )
A.次氯酸的电子式
B.表示中和热的热化学方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l)△H=-57.3kJ/mol
C.H2S电离的方程式为:H2S2H++S2-
D.标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子难度: 中等查看答案及解析
-
下列说法正确的是( )
A.液化石油气和天然气的主要成分都是甲烷
B.苯分子中的6个碳原子之间的键完全相同,是一种介于单键和双键之间的独特的键
C.3-甲基戊烷的一氯代产物有(不考虑立体异构)五种
D.1mol葡萄糖可水解生成2mol乳酸(C3H6O3)难度: 中等查看答案及解析
-
木糖醇是一种新型的甜味剂,近年来正悄悄的走进人们的生活.木糖醇是一种理想的蔗糖代替品,它具有甜味适中、溶解性好、防龋齿、适合糖尿病患者等优点.木糖醇是一种白色粉末状的固体,结构简式为:CH2OH(CHOH)3CH2OH,下列有关木糖醇的叙述正确的是( )
A.木糖醇与核糖(C5H10O5)互为同分异构体
B.木糖醇与葡萄糖一样是一种单糖
C.木糖醇可以与乙酸发生酯化反应
D.木糖醇与甘油(CH2OHCHOHCH2OH)互为同系物难度: 中等查看答案及解析
-
关于下列四个图象的说法中正确的是( )
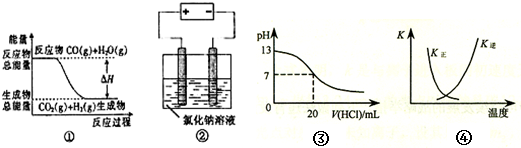
A.图①表示可逆反应“CO(g)+H2O(g)CO2(g)+H2(g)”中的△H大于0
B.图②是在以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1:1
C.图③表示25℃时,用0.1mol•L-1盐酸滴定20mL0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化
D.图④中曲线表示反应2SO2(g)+O2(g)2SO3(g);△H<0正、逆反应的平衡常数K随温度的变化
难度: 中等查看答案及解析
-
下列推断或表述正确的是( )
A.在醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b
B.向2.0mL浓度均为0.1 mol•L-1的KCl、KI混合液滴加1~2滴0.01 mol•L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小
C.0.2 mol/L的一元酸HX与0.1 mol/L的KOH溶液等体积混合所得溶液中,一定有:c(H+)+c(K+)=c(OH-)+c(X-)
D.0.2 mol•L-1盐酸与等体积0.05 mol•L-1Ba(OH)2溶液混合后,溶液pH为1难度: 中等查看答案及解析
-
铁和氧化铁的混合物共x mol,加盐酸后固体全部溶解,共收集到y mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为( )
A.(x+y)mol
B.(x-y)mol
C.(x-y)mol
D.(x+y)mol难度: 中等查看答案及解析