-
在火星上工作的美国“勇气号”、“机遇号”探测车的一个重要任务就是收集有关Fe2O3及硫酸盐的信息,以证明火星上存在或曾经存在过水。以下叙述正确的是 ( )
A. 铝热剂就是单指Fe2O3粉和铝粉的混合物
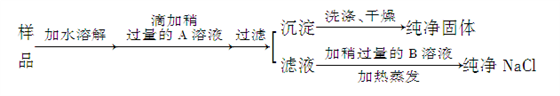
B. 检验从火星上带回来的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液
C. 分别还原a mol Fe2O3所需H2、Al、CO的物质的量之比为3:2:3
D. 明矾属硫酸盐,含结晶水,是混合物
难度: 中等查看答案及解析
-
2015年8月12日天津港瑞海公司危险化学品仓库发生特大火灾爆炸事故,事故警示我们,化学药品的安全存放是非常重要的。下列有关化学药品的存放说法不正确的是( )
A. 液溴易挥发,应用少量的水液封并放在冷暗处保存
B. 硝酸见光易分解、易挥发,应用棕色广口试剂瓶密封保存
C. 金属钠遇到氧气和水均立即反应,应保存在煤油中或者液体石蜡里
D. 碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存
难度: 简单查看答案及解析
-
2molCl2和2molCO2相比较,下列叙述中正确的是 ( )
A. 分子数相等 B. 原子数相等 C. 体积相等 D. 质量相等
难度: 中等查看答案及解析
-
生活中的一些问题常涉及到化学知识,下列叙述正确的是( )
A. 晶体硅具有半导体的性质,所以可以制作光导纤维
B. 氯化铁溶液可用于制作印刷电路板是因为其具有氧化性,与铜发生置换反应
C. 明矾和漂白粉常用于自来水的处理,两者的作用原理相同
D. 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
难度: 中等查看答案及解析
-
化学是以实验为基础的学科,化学实验设计和操作中必须十分重视安全问题和环境问题,下列操作方法不正确的是( )
A. 制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
B. 在气体发生装置上直接点燃乙烯气体时,先检查乙烯气体的纯度
C. 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
D. 给试管中的液体加热时不停移动试管或加入碎瓷片,以免暴沸伤人
难度: 中等查看答案及解析
-
下列数量的各物质所含原子个数由大到小顺序排列的是( )
①0.5 mol氨气 ②4 g氦气 ③4℃时9 mL水④0.2 mol磷酸钠
A. ①④③② B. ④③②①
C. ②③④① D. ①④②③
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,11.2 L水中含有分子的数目为0.5NA
B. 100 mL 0.2 mol·L-1的FeCl3溶液中,含Fe3+数为0.02NA
C. 1 mol Cl2与足量的NaOH溶液反应,转移的电子数为1NA
D. 在密闭容器中加入0.5 mol N2和1.5 mol H2,充分反应后可得到NH3分子数为NA
难度: 中等查看答案及解析
-
下列指定微粒的数目相等的是( )
A. 等物质的量的CaCl2和CaO2含有的离子数
B. 等温等压下,质子数相等的CO、N2、C2H2三种气体含有的原子数
C. 同温、同压、同体积的CO和NO含有的质子数
D. 物质的量相同的铁和铝分别与足量氯气完全反应时转移的电子数
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 稀盐酸可除去烧瓶内残留的MnO2 B. 可用磨口玻璃瓶保存NaOH溶液
C. 稀硝酸可除去试管内壁的银镜 D. 煮沸自来水可除去其中的CaCO3
难度: 中等查看答案及解析
-
化学反应中会出现“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是( )
①过量稀硫酸与块状石灰石;②过量的氢气与少量氮气在催化剂存在下充分反应;
③过量稀硝酸与银反应;④过量铜与浓硫酸;
⑤浓盐酸与过量的MnO2 ⑥过量的锌与18mol/L的硫酸反应;
A. ③④⑥ B. ②③⑤ C. ①②④⑤ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
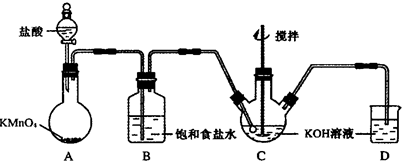
根据实验目的判断下列实验操作或装置正确的是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol·L-1 NaCl溶液中含有的Na+离子数目为0.1NA
B. 室温下,1L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 5NH4NO3
2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA
D. 常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,32gSO3的体积约为11.2L
B. 2.0gH218O与D2O的混合物中所含中子数为NA
C. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA
D. 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
下列混合物的分离或提纯操作中不正确的是( )
A. 除去N2中的少量O2,可通过灼热的Cu网后,收集气体
B. 除去Fe(OH)3胶体中混有的Cl- 离子,可用渗析的方法
C. 除去乙醇中的少量NaCl,可用蒸馏的方法
D. 重结晶、滴定操作都可用于提纯物质
难度: 中等查看答案及解析
-
在标准状况下有:①6.72 L CH4;②3.01×1023个氯化氢分子;③13.6 g硫化氢;④0.2 mol NH3。
下列对这四种气体相关量的比较不正确的是( )。
A. 体积:②>③>①>④ B. 密度:②>③>④>①
C. 质量:②>③>①>④ D. 氢原子数:①>④>③>②
难度: 简单查看答案及解析
-
某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-= Cl-+ ClO-+ H2O
B. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
C. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO—
D. 该消毒液的pH约为12:ClO-+ H2O
HClO+ OH-
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列关于0.2 mol/L Ba(NO3)2溶液的叙述不正确的是( )
A. 2 L溶液中阴阳离子总数大约为1.2NA
B. 500 mL溶液中NO
浓度为0.2 mol/L
C. 500 mL溶液中Ba2+浓度为0.2 mol/L
D. 500 mL溶液中NO
物质的量为0.2 mol
难度: 简单查看答案及解析
-
有200 mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2 mol·L-1,c(Cl-)为1.3 mol·L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4 mol·L-1 NaOH溶液的体积为( )
A. 40 mL B. 72 mL C. 80 mL D. 128 mL
难度: 简单查看答案及解析