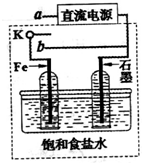
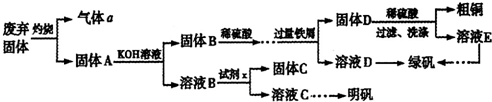
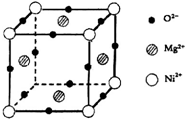
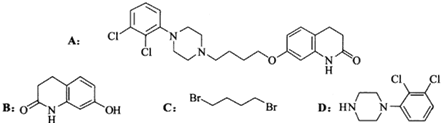
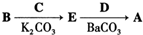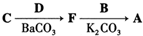-
化学在生产和日常生活中有着重要的应用.下列叙述不正确的是( )
A.晶体硅是光导纤维、芯片的主要成分
B.在海轮外壳上镶嵌锌块,会减缓船体的锈蚀
C.工业上用石灰对煤燃烧后的烟气进行脱硫,并能制取石膏
D.氯气是合成农药、染料和药品的重要原料难度: 中等查看答案及解析
-
下列说法正确的是( )
A.相同物质的量的O2和O3,体积相同
B.离子化合物一定含有离子键,可能含有共价键
C.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S
D.常温下,等体积、pH均为3的醋酸和硫酸分别与完全相同的镁条反应,硫酸产生氢气速率快难度: 中等查看答案及解析
-
下列关于常见有机化合物的说法中正确的是( )
A.分子式为C4H10的物质具有三种分子结构
B.甲烷、苯、乙酸在一定条件下都能发生取代反应
C.丝绸和棉花的组成元素相同,分子结构不同,因而性质不同
D.用氢氧化钠溶液与乙酸乙酯充分混合并振荡,以除去其中的乙酸难度: 中等查看答案及解析
-
下列说法正确的是( )
A.金属元素不可能形成含氧酸根离子
B.元素R的含氧酸的化学式是H2RO3,则其气态氢化物的化学式就是RH4
C.金属与非金属元素分界线附近的元素是过渡元素
D.形成化合物种类最多的元素在IVA族难度: 中等查看答案及解析
-
下列实验方案可行或结论正确的是( )
A.用饱和Na2CO3溶液除去CO2中的HCl
B.可用加热氯化铵的方法制取氨气
C.用加热的方法可除去碳酸钠粉末中的碳酸氢钠
D.在酸碱中和滴定实验中,当锥形瓶中溶液的颜色发生突变时即达到滴定终点难度: 中等查看答案及解析
-
下列说法正确的是( )
A.0.1mol氯气与足量氢氧化钠溶液(常温)反应,转移电子0.1NA
B.常温下将醋酸钠、盐酸两溶液混合后溶液呈中性,则混合溶液中:c(Na+)=c(Cl-)
C.某溶液中水电离出的c(H+)=1.0×10-12mol/L,则此溶液中K+、、Cl-、
可以大量共存
D.常温下物质的量浓度相等的①(NH4)2CO3溶液、②(NH4)2SO4溶液和③NH4Cl溶液中,水的电离程度:①>③>②难度: 中等查看答案及解析
-
一定质量的某铁的氧化物FexOy,与足量4mol/L稀硝酸溶液充分反应,消耗硝酸700mL,放出2.24L NO气体(标准状况).则该铁的氧化物的化学式为( )
A.FeO
B.Fe2O3
C.Fe3O4
D.Fe8O10难度: 中等查看答案及解析
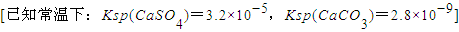 .
.