-
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为
A.生石灰、漂白粉、氯化铜、碳酸钠
B.胆矾、盐酸、铁、碳酸钙
C.蒸馏水、氨水、碳酸氢钠、二氧化硫
D.纯盐酸、空气、硫酸、干冰
难度: 简单查看答案及解析
-
在Al(NO3)3和NaHSO4的混合溶液,能够大量共存的粒子组是
A.Ba2+、OH-、Mg2+、Cl-
B.Fe2+、SO
、Cu2+、AlO
C.HCO
、I-、Cl-、Cu2+
D.Fe3+、Cu2+、Cl-、H+、
难度: 中等查看答案及解析
-
设n为阿伏加德罗常数的值。则下列说法不正确的是
A.4.6g 金属钠与足量O2充分反应后,所得固体中阴、阳离子的总数为0.3n
B.1 L 0.5 mol/L 的FeCl3溶液充分水解后,所得Fe(OH)3胶粒的数目为0.5n
C.过量的Fe与1 mol Cl2充分反应,转移电子的数目为2n
D.1 L含n个Al3+的Al(NO3)3溶液中,NO
物质的量浓度大于3 mol/L
难度: 中等查看答案及解析
-
一定条件下,K37ClO3+6H35Cl(浓)
KCl+ 3Cl2↑+3H2O,则下列判断正确的是
A.生成0.3 mol Cl2时,转移电子的物质的量为0.6 mol
B.该反应中,生成的Cl2的摩尔质量约为70.7 g/mol
C.被0.1 mol K37ClO3氧化的H35Cl的物质的量为0.6 mol
D.该反应中,H35Cl发生氧化反应,KCl是还原产物
难度: 中等查看答案及解析
-
下列实验现象所对应的离子方程式不正确的是
选项
实 验
现 象
离子方程式
A

在空气中放置一段时间后,溶液呈蓝色
4H++4I-+O2===2I2+2H2O
B

溶液由浅绿色变为红色
2Fe2++Cl2===2Fe3++2Cl-、
Fe3++3SCN-===Fe(SCN)3
C

溶液由黄绿色变为无色
Cl2+2OH-===Cl-+ClO-+H2O
D

有白色沉淀生成,溶液由红色变为无色
Ba2++OH-+H++
===BaSO4↓+H2O
难度: 中等查看答案及解析
-
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如下图所示,则下列选项正确的是
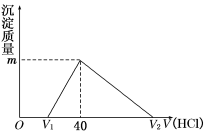
A.图中m值为1.56 g
B.标准状况下产生氢气896 mL
C.图中V2为60 mL
D.原合金质量为0.92 g
难度: 困难查看答案及解析
-
下列说法正确的是
A.向磁性氧化铁溶解于足量稀盐酸后的溶液中滴加酸性KMnO4溶液,紫红色消失,表明溶液中含有Fe2+
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.FeCl3、FeCl2、Fe(OH)3三种化合物都可以通过化合反应制得
D.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成
难度: 中等查看答案及解析




 ;
;