-
化学与社会、生活密切相关。下列现象或事实以及解释均正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关文献记载中涉及的化学知识表述不正确的是
A. “以曾青涂铁,铁赤色如铜”说明我国古代就掌握了“湿法冶金”技术
B. “煤饼烧蛎房成灰(蛎房即牡蛎壳)”中灰的主要成分为氧化钙
C. “丹砂烧之成水银,积变又还成丹砂”讲的是单质与化合物之间的互变
D. “墙塌压糖,去土而糖白”中的脱色过程发生了化学变化
难度: 中等查看答案及解析
-
用NA表示阿伏伽德罗常数的值,下列说法正确的是
A. 1 L1mol·L-1CH3COOH溶液中所含分子数小于NA
B. 常温下,23gNO2和N2O4混合气体中含有原子数为1.5NA
C. 电解精炼铜时,阴极得到的电子数为2NA,则阳极质量减少64g
D. 标准状况下,11.2L氨水含有0.5NA个NH3分子
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A. NaHCO3溶液中加入稀HCl:CO32-+2H+===CO2↑
B. 碳酸钠溶液显碱性:CO32-+H2O
HCO3-+OH-
C. Na2O2溶于水产生O2:Na2O2+H2O===2Na++2OH-+O2↑
D. 碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-===CO32-+H2O
难度: 中等查看答案及解析
-
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为( )
A. NaHCO3、Al(OH)3 B. AgCl、NaHCO3
C. Na2SO3、BaCO3 D. Na2CO3、CuSO4
难度: 中等查看答案及解析
-
某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论正确的是( )
A. 铜与浓硫酸反应所得白色固体不是CuSO4
B. 加BaCl2溶液后所得白色沉淀是BaSO3
C. 白色固体中夹杂的少量黑色物质可能是CuO
D. 白色固体中夹杂的少量黑色物质中一定含有元素Cu和S
难度: 中等查看答案及解析
-
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是
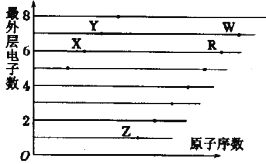
A. X和R最高价相同
B. 原子半径:W>R>Z>X>Y
C. 气态氢化物的稳定性:X>Y
D. R、W形成的化合物中可能含有极性键和非极性键
难度: 中等查看答案及解析
-
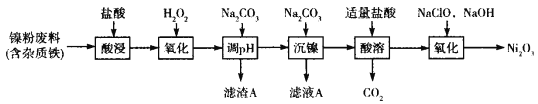
下图是部分矿物资源的利用及产品流程,有关说法不正确的是
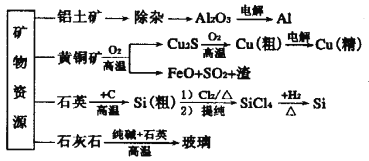
A. 电解冶炼铝时产生副产物不处理可导致温室效应
B. 上述生产过程既涉及氧化还原反应,又涉及非氧化还原反应
C. 黄铜矿冶铜时,将矿石粉碎以提高生产效率
D. 粗硅制高纯硅时,提纯四氯化硅可用过滤、分馏的方法
难度: 中等查看答案及解析
-
原子序数依次增大的五种短周期主族元素X、Y、Z、、P、Q分别位于三个周期,X与Z、Y与P分别位于同主族,Z与Y可形成原子个数比分别为1:1和2:1的离子化合物。则下列说法正确的是
A. 单质的沸点:Q>P
B. 简单氢化物的热稳定性:Y>P
C. 简单离子的半径:Z>Y>X
D. X、Y、Z、P形成的化合物的水溶液显碱性
难度: 中等查看答案及解析
-
下列有关实验的操作正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
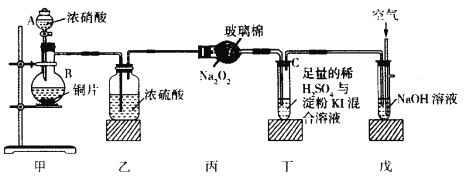
利用如图装置进行“氨的催化氧化”实验(固定装置略去)。下列说法错误的是
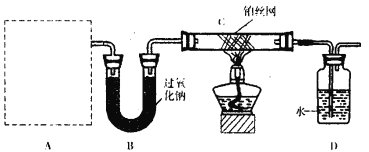
A. 装置A中盛放的药品可以是碳酸氢铵
B. 装置C的右端可看到红棕色气体
C. 若装置B中药品足量,则装置D生成的溶液可溶解铜粉
D. 该装置可能引起倒吸,但不会造成环境污染
难度: 中等查看答案及解析
-
某消毒液的主要成分为NaClO,还含有一定量的NaOH,下列用来解释事实的方程式中不合理的是(已知:饱和NaClO溶液的pH约为11)( )
A. 该消毒液可用NaOH溶液吸收Cl2制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O
B. 该消毒液的pH约为12:ClO-+ H2O
HClO+ OH-
C. 该消毒液与洁厕灵(主要成分为HCl)混用,产生Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
D. 该消毒液加白醋生成HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO—
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的短周期元索,Y、Z、W原子的最外层电子数之和为14,含有Y元素的阴离子和阳离子在溶液中能反应生成沉淀,Z原子的最外层电子数 是内层电子数的2/5,X的氢化物分子式为XH4。下列说法正确的是
A. X、Z能形成共价化合物
B. W的阴离子半径大于硫离子半径
C. 含有W元素的酸都有漂白性
D. 室温下,含Y元素的阳离子与任何碱反应可转化为含有Y元素的阴离子
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作
实验现象
结 论
A
测定等浓度的Na2CO3和Na2SO3 溶液的pH
前者pH比后者的大
非金属性:S>C
B
氯水中滴入少量品红溶液
品红褪色
氯气有漂白性
C
向等浓度的KCl、KI混合液中滴加AgNO3溶液
先出现黄色沉淀
Ksp(AgCl)<Ksp(AgI)
D
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置
下层液体显紫红色
氧化性:Fe3+>I2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
中学常见的短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占据三个周期。Y和M位于同主族,Y原子最外层电子数是电子层数的3倍。这五种元素组成一种离子化合物Q。取一定量Q溶于蒸馏水得到溶液,向溶液中滴加稀氢氧化钠溶液,产生沉淀与氢氧化钠溶液体积如图所示。下列说法不正确的是
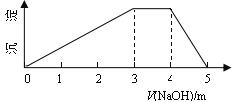
A. 简单的离子半径:M>Y>Z
B. 气态氢化物的热稳定性:Y>X
C. 最高价氧化物对应水化物的酸性:M>Z
D. 由R、X、Y、M四种元素只组成一种盐
难度: 困难查看答案及解析
-
某稀溶液中含有4 mol KNO3和2.5 mol H2SO4,向其中加入1. 6mol Fe,充分反应(已知NO
被还原为NO)。下列说法正确的是( )
A. 被还原的硝酸是1.25mol
B. 所得溶液中c(Fe2+)∶c(Fe3+)=1∶1
C. 所得溶液中n(NO3-)=2.75 ,该溶液含还可溶解铁0.375mol.
D. 所得溶液中的溶质只有FeSO4
难度: 中等查看答案及解析