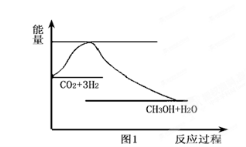
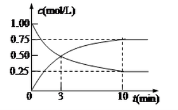
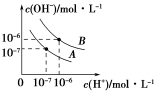
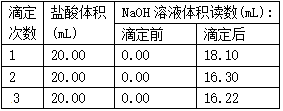
-
废电池造成污染的问题日益受到关注。下列有关电池的说法正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.弱电解质在水中的电离程度很小,不能用作电池的电解质溶液
C.原电池是将化学能完全转变为电能的装置
D.回收废旧电池,可防止汞、镉和铅等重金属对土壤和水源的污染
难度: 中等查看答案及解析
-
有文献报道,硫在空气中燃烧时,产物中SO3约占5% ~ 6%(体积比,下同),而硫在纯氧气中燃烧时,其产物中的SO3约占2% ~ 3%,解释这一事实的理由正确的是( )
A.在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动
B.在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生
成SO3的方向移动
C.在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响
D.没有使用催化剂
难度: 困难查看答案及解析
-
铜锌原电池(如图)工作时,下列叙述正确的是( )
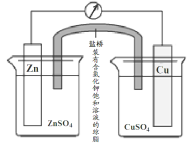
A.在外电路中,电流从Zn极流向Cu极
B.盐桥中的Cl-移向CuSO4溶液
C.当负极减小65g时,正极增加65g
D.电池的总反应为 Zn + Cu2+=Zn2+ + Cu
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列化学用语中,正确的是( )
A.NH的水解反应离子方程式:NH+H2O
NH3·H2O+
H+
B.在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-===AgI↓
C.锌铜原电池,负极的电极反应式为: Cu2++2e-=== Cu
D.某反应ΔH<0,则该反应在任意条件下均可自发进行
难度: 中等查看答案及解析
-
一定温度下,下列叙述是可逆反应A(g)+3B(g)
2C(g)在定容密闭容器中达到平衡的标志的是:( )
①C的生成速率与C的分解速率相等;
②单位时间内amol A生成,同时生成3amolB;
③A、B、C的浓度不再变化;
④混合气体的总压强不再变化;
⑤混合气体的平均摩尔质量不再变化;
⑥用A、B、C的物质的量浓度变化表示的反应速率之比为1:3:2;
⑦A、B、C的分子数目比为1:3:2;
⑧混合气体的密度不再变化
A.②⑤ B.①③④⑤ C.②⑥⑦⑧ D.⑤⑥⑧
难度: 中等查看答案及解析
-
下列实验误差分析错误的是( )
A.用润湿的pH试纸测稀碱溶
液的pH,测定值偏小
B.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而
使有效碰撞次数增多
B.有气体参加的反应,若增大压强,可增大活化分子的百分数,从而使反应速率增大
C.升高温度能使反应速率增大的主要原因是减小了反应物分子中活化分子的百分数
D.催化剂能增大活化分子的百分数,从而成千上万倍地增大反应速率
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.H2(g)的燃烧热ΔH=-285.8 kJ/mol,
则2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ/ mol
B.反应物的总能量低于生成物的总能量时,该反应为放热反应
C.由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s) ΔH<0
D.已知:298 K时,N2(g)+3H2(g)
2NH3(g) ΔH =-92.0 kJ/mol。在相同温度下,向密闭容器中通入0.5 mol N2和1.5 mol H2,达到平衡时放出46.0 kJ的热量
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.由水电离的H+离子浓度等于10-12mol/L的溶液中:Na+、K+、NO3-、HCO3-
B.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
C.加酚酞呈红色的溶液中:CO32-、Cl-、F-、NH4+
D.c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、Cl-、Fe3+
难度: 困难查看答案及解析
-
浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随lg的变化如图所示,下列叙述错误的是( )

A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lg=2时,若两溶液同时升高温度,则c(M+)/c(R+)增大
难度: 困难查看答案及解析
-
某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表
,下列说法错误的是( )
物质
X
Y
Z
W
初始浓度/mol·L-1
0.5
0.6
0
0
平衡浓度/mol·L-1
0.1
0.1
0.4
0.6
A.反应达到平衡时,X的转化率为80%
B.该反应的平衡常数表达式为K=
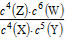
C.增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D.改变温度可以改变此反应的平衡常数
难度: 中等查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol·L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:
c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
D.pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③
难度: 中等查看答案及解析
-
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸(无水醋酸)中的电离常数:从下表格中判断下列说法正确的是( )
酸
HClO4
H2SO4
HCl
HN
O3
Ka
1.6×10-5
6.3×10-9
1.6×10-9
4.2×10-10
A.水对于这四种酸的强弱没有区分能力,
但醋酸可以区别这四种酸的强弱
B.在冰醋酸中高氯酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO42-
D.在冰醋酸和水中这四种酸都没有完全电离
难度: 困难查看答案及解析
-
25 ℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A.向同浓度的Na2SO4和Na2CO3的混合溶液中滴加BaCl2溶液,BaSO4先
析出
B.向BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C.BaSO4和BaCO3共存的悬浊液中,
=
D.向BaSO4的悬浊液中加入Na2CO3的浓溶液,BaSO4不可能转化为BaCO3
难度: 中等查看答案及解析
-
今有室温下四种溶液,有关叙述不正确的是( )
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸
盐
酸
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①、④两溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D.VaL④与VbL②溶液混合后,若混合后溶液pH=4,则Va∶Vb=11∶9
难度: 中等查看答案及解析
-
25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )
A.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1HCl溶液等体积混合:
c(Na+)=c(Cl-)>c(CH3COO-)>c(H+)
B.0.1 mol·L-1NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):
c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1 mol·L-1Na2CO3溶液与0.1 mol·L-1NaHCO3溶液等体积混合:
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1 mol·L-1Na2C2O4溶液与0.1 mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):
2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
难度: 困难查看答案及解析