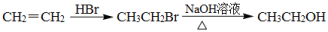-
化学与社会、科学、技术、环境、生活等有密切关系,下列说法正确的是( )
A.苹果放在空气中久置变黄和纸张久置变黄原理相似
B.合成洗涤剂和纯碱溶液都可洗去油污的原理相同
C.纤维素食用在人体内水解为葡萄糖为人体提供能量
D.SO2具有还原性,可用已知浓度的KMnO4溶液测定食品中SO2残留量
难度: 简单查看答案及解析
-
某有机化合物的结构简式如图所示,下列说法正确的是( )
A.不能发生银镜发应
B.1mol 该物质最多可与2molBr2反应
C.1mol 该物质最多可与4mol NaOH反应
D.与NaHCO3、Na2CO3均能发生反应
难度: 简单查看答案及解析
-
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。说法正确的是( )
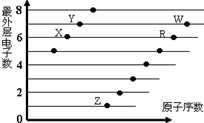
A. X与W形成的化合物中只有共价键
B. X与Z形成的化合物中只有离子键
C. 元素的非金属性: X>R>W
D. 简单离子的半径:W>R>X
难度: 简单查看答案及解析
-
下列根据实验操作和现象得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
将少量Fe(NO3)2试样加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液
溶液变成血红色
Fe(NO3)2试样已变质
B
向甲苯中滴加少量酸性高锰酸钾溶液
高锰酸钾溶液褪色
甲苯发生了氧化反应
C
常温下分别测定浓度均为0.1mol/L的Na2SiO3溶液和Na2CO3溶液的pH
pH:Na2SiO3>Na2CO3
非金属性:Si>C
D
将少量某无色气体通入澄清石灰水中
出现白色沉淀
该气体一定是CO2
难度: 简单查看答案及解析
-
一种二次电池如图所示,该电池的电解质为强碱溶液,下列说法中正确的是( )
A.充电时阴极发生氧化反应
B.充电时将碳电极与电源的正极相连
C.放电时碳电极反应为原电池的负极
D.放电时镍电极反应为Ni(OH)2-e-+OH-=NiO(OH)+H2O
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.9 g超重水(3H216O)含中子数为6NA
B.标准状况下,22.4 L CCl4含有的分子数目为NA
C.常温常压下,16g甲烷中共价键数目为4NA
D.1 L 0.1 mol·L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1 NA
难度: 简单查看答案及解析
-
常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是( )

A.A点溶液中加入少量水:
增大
B.B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C.C点:c(Na+) =c(HA-)+2c( A2-)
D.水电离出来的c(OH -):B点>D点
难度: 简单查看答案及解析
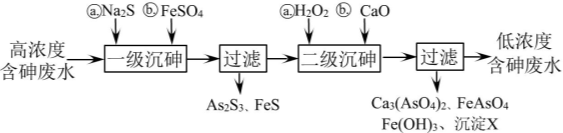
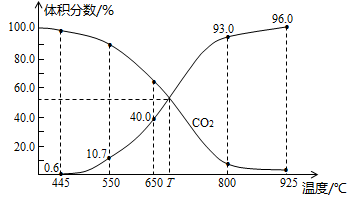
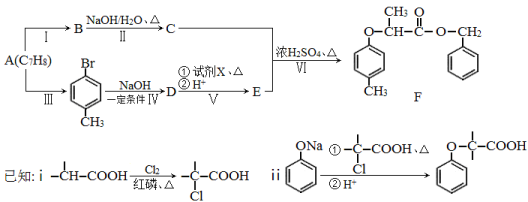
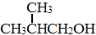 为原料制取
为原料制取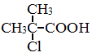 的合成路线图。
的合成路线图。