-
固体硝酸盐加热易分解且产物较复杂。某学习小组以Mg(NO3)2为研究对象,拟通过实验探究其热分解的产物,提出如下4种猜想:
甲:Mg(NO2)2、NO2、O2
乙:MgO、NO2、O2
丙:Mg3N2、O2
丁:MgO、NO2、N2
(1)实验小组成员经讨论认定猜想丁不成立,理由是_______________________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
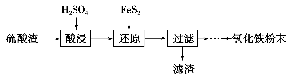
针对甲、乙、丙猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略):

(2)实验过程
①仪器连接后,放入固体试剂之前,关闭k,微热硬质玻璃管(A),观察到E中有气泡连续放出,表明__________。
②称取Mg(NO3)2固体3.7 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是________;关闭k,用酒精灯加热时,正确操作是先________,然后固定在管中固体部位下加热。
③观察到A中有红棕色气体出现,C、D中未见明显变化。
④待样品完全分解,A装置冷却至室温、称量,测得剩余固体的质量为1.0 g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①根据实验现象和剩余固体的质量经分析可初步确认猜想______是正确的。
②根据D中无明显现象,一位同学认为不能确认分解产物中有O2,因为若有O2,D中将发生氧化还原反应:______________(填写化学方程式),溶液颜色会褪去;小组讨论认定分解产物中有O2存在,未检测到的原因是__________
____________________________________________________。
③小组讨论后达成的共识是上述实验设计仍不完善,需改进装置进一步探究。
难度: 困难查看答案及解析
-
硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】 ①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃;②2B+6HCl
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
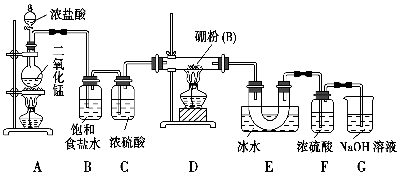
【设计实验】 某同学设计如图所示装置制备三氯化硼:
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:___________________________________。
(2)E装置的作用是_______________________________________________。
如果拆去B装置,可能的后果是______________________________________
(3)写出D装置中发生反应的化学方程式:_____________________________
实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式:__________________________________________________________;
实验室保存三氯化硼的注意事项是_________________________________。
(5)为了顺利完成实验,正确的操作是________(填序号),并解释原因:________。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:________________________________________________。
难度: 困难查看答案及解析
-
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
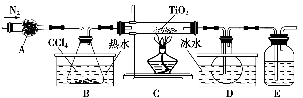
(1)实验室利用反应TiO2(s)+CCl4(g)
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
有关物质性质如下表:
物质
熔点/℃
沸点/℃
其他
CCl4
-23
76
与TiCl4互溶
TiCl4
-25
136
遇潮湿空气产生白雾
仪器A的名称是________。装置E中的试剂是________。反应开始前依次进行如下操作:组装仪器、________、加装药品、通N2一段时间后点燃酒精灯。反应结束后的操作包括:①停止通N2 ②熄灭酒精灯 ③冷却至室温。正确的顺序为________(填序号)。欲分离D中的液态混合物,所采用操作的名称是________。
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶 FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+TiOSO4(aq)+2H2O(l)
水解 TiOSO4(aq)+2H2O(l)
H2TiO3(s)+H2SO4(aq)
简要工艺流程如下:
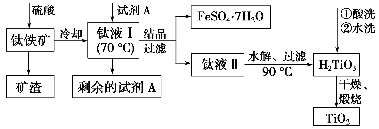
①试剂A为________。钛液Ⅰ需冷却至70 ℃左右,若温度过高会导致产品TiO2产率降低,原因是_________________________________________________
_______________________。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是________。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是____________________(填化学式)。
难度: 极难查看答案及解析
-
碳酸钠—过氧化氢加合物(aNa2CO3·bH2O2)具有漂白、杀菌作用。实验室用“醇析法”制备该物质的实验步骤如下:
第1步:取适量碳酸钠溶解于一定量水里,倒入烧瓶中;再加入少量稳定剂(MgCl2和Na2SiO3),搅拌均匀。
第2步:将适量30%的H2O2溶液在搅拌状态下滴入烧瓶中,于15 ℃左右反应1 h。
第3步:反应完毕后再加入适量无水乙醇,静置、结晶,过滤、干燥得产品。
(1)第1步中,稳定剂与水反应生成两种常见的难溶物,其化学方程式为___________________________________________________________。
(2)第2步中,反应保持为15 ℃左右可采取的措施是_____________________
___________________________________________________。
(3)第3步中,无水乙醇的作用是____________________________________。
(4)H2O2的含量可衡量产品的优劣。现称取m g(约0.5 g)样品,用新煮沸过的蒸馏水配制成250 mL溶液,取25.0 mL于锥形瓶中,先用稀硫酸酸化,再用c mol·L-1 KMnO4溶液滴定至终点。
①配制250 mL溶液所需的玻璃仪器有烧杯、玻璃棒、量筒________、________;
②滴定终点观察到的现象是______________________________________。

(5)可模拟用蒸馏法测定样品中碳酸钠的含量。装置如右图所示(加热和固定装置已略去),实验步骤如下:
步骤1:按右图所示组装仪器,检查装置气密性。
步骤2:准确量取(4)中所配溶液50 mL于烧瓶中。
步骤3:准确量取40.00 mL约0.2 mol·L-1 NaOH溶液两份,分别注入烧杯和锥形瓶中。
步骤4:打开活塞K1、K2,关闭活塞K3缓缓通入氮气一段时间后,关闭K1、K2,打开K3;经分液漏斗向烧瓶中加入10 mL 3 mol·L-1硫酸溶液。
步骤5:加热至烧瓶中的液体沸腾,蒸馏,并保持一段时间。
步骤6:经K1再缓缓通入氮气一段时间。
步骤7:向锥形瓶中加入酸碱指示剂,用c1 mol·L-1 H2SO4标准溶液滴定至终点,消耗H2SO4标准溶液V1 mL。
步骤8:将实验步骤1~7重复两次。
①步骤3中,准确移取40.00 mL NaOH溶液所需要使用的仪器是________;
②步骤1~7中,确保生成的二氧化碳被氢氧化钠溶液完全吸收的实验步骤是________(填序号);
③为获得样品中碳酸钠的含量,还需补充的实验是______________________。
难度: 极难查看答案及解析
-
用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[w(Fe)],实验步骤如下:
步骤1:称取试样0.100 g于250 mL洗净的锥形瓶中。
步骤2:加入FeCl3溶液100 mL,迅速塞上胶塞,用电磁搅拌器搅拌30 min。
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中。
步骤4:将滤液稀释至500 mL,再移取100 mL稀释液于锥形瓶中,加入20 mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴。
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点。发生的反应为Cr2O72—+6Fe2++14H+=2Cr3++6Fe3++7H2O。
步骤6:重复测定两次。
步骤7:数据处理。
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为________________,迅速塞上胶塞的原因是______________________________
(2)步骤3中判断滤纸上残渣已洗净的方法是_____________________________
(3)实验中需用到100 mL浓度约为0.01 mol·L-1K2Cr2O7标准溶液,配制时用到的玻璃仪器有________________。称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是________(填“偏高”、“偏低”或“无影响”);滴定时,K2Cr2O7溶液应置于________(填仪器名称)中。
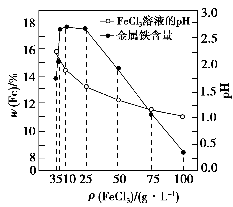
(4)科研人员为确定FeCl3溶液的最佳浓度,选用100 mL不同浓度的FeCl3溶液(FeCl3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示。则FeCl3溶液的浓度[用ρ(FeCl3)表示]范围应为________g·L-1,浓度过低或过高时测定结果偏低的原因分别是_________________________。
难度: 困难查看答案及解析