-
化学与人类生产、生活,社会可持续发展密切相关。下列说法正确的是
A.蔬菜表面洒少许福尔马林,可保鲜和消毒
B.绿色食品就是不使用化肥农药,不含任何化学物质的食品
C.推广纳米TiO2光触媒技术铺设“生态马路”,将汽车尾气转化为无害物质
D.推广使用煤液化技术可减少二氧化碳温室气体气体的排放
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.1mol甲醇中含有C—H键的数目为4NA
B.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.Na2O2与足量H2O反应产生0.2mol O2,转移电子的数目为0.4NA
D.标准状况下,2.24 L己烷含有分子的数目为0.1 NA
难度: 中等查看答案及解析
-
咖啡酸可用作化学原料和中间体,其结构如图。下列关于咖啡酸说法不正确的是

A.能发生加聚反应
B.能使高锰酸钾酸性溶液褪色
C.1 mol咖啡酸最多能与3 mol NaOH反应
D.1 mol咖啡酸最多能与 3 mol Br2反应
难度: 中等查看答案及解析
-
近年来,莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图:

下列关于莽草酸的说法不正确的是
A.莽草酸的相对分子质量为174
B.分子中含有两种含氧官能团
C.可发生取代、加成反应及氧化反应
D.在水溶液中羟基和羧基均能电离出氢离子
难度: 中等查看答案及解析
-
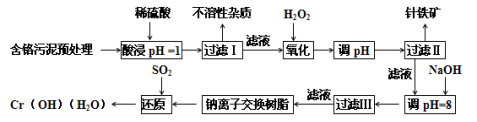
已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示。则甲和X 不可能是

A.甲为C,X为O2
B.甲为SO2,X为NaOH溶液
C.甲为Fe,X为Cl2
D.甲为AlCl3,X为NaOH溶液
难度: 困难查看答案及解析
-
下列各组离子在常温下一定能大量共存的是
A.pH=0的无色溶液中:Cl-、Na+、SO42-、Fe2+
B.在c(H+)/c(OH-)=1012的溶液中:NH4+、NO3-、K+、Cl-
C.加入铝粉能放出H2的溶液中:Mg2+、NH4+、NO3-、Cl-
D.含有大量Fe3+的溶液中:Al3+、SCN-、Br-、Na+
难度: 中等查看答案及解析
-
硫化汞(HgS)难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等。某温度时,HgS在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.向硫化汞的浊液中加入硫化钠溶液,硫化汞的Ksp减小
B.图中a点对应的是饱和溶液
C.向c点的溶液中加入Hg(NO3)2,则c(S2-)减小
D.升高温度可以实现c点到b点的转化
难度: 困难查看答案及解析