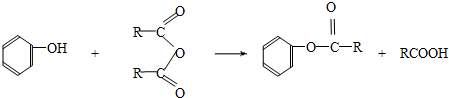
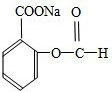
-
根据如图表示的一些物质或概念间的从属关系,下列各项中不正确的是:( )
X Y Z A 水泥 硅酸盐产品 无机非金属材料 B 胶体 分散系 混合物 C 电解质 离子化合物 化合物 D 吸氧腐蚀 电化学腐蚀 金属腐蚀 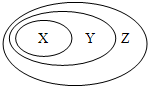
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
在溶液中能大量共存的一组离子或分子是( )
A.H+、Cl-、CH3COO-、NO3-
B.K+、CH3COO-、SO32-、OH-
C.H+、Fe2+、SO42-、H2O2
D.K+、Ag+、NO3-、NH3•H2O难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A.乙烯和苯都能与溴水反应
B.己烷和维生素C不可用酸性高锰酸钾鉴别
C.糖类、蛋白质、油脂都属于高分子化合物
D.乙酸和油脂都能与氢氧化钠溶液反应难度: 中等查看答案及解析
-
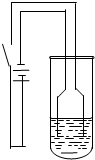
用下列实验装置进行对应的实验(部分装置工某些仪器已省略),其中可行的是( )
A.
收集Cl2
B.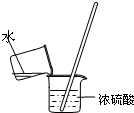
稀释浓硫酸
C.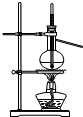
石油的分馏
D.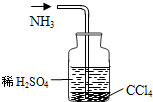
吸收NH3难度: 中等查看答案及解析
-
在一密闭器中通入N2和H2,在一定条件下发生反应:N2+3H2═2NH3△<0,达到平衡后,只改变其中一个条件(X),下 量(Y)的变化一定符合图中曲线的是:( )
X Y A 再加入N2 H2的转化率 B 再加入NH3 N2的体积分数 C 增大体积 N2的转化率 D 升高温度 混合气体密度
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如下的转化关系(部分产物及反应条件已略去):下列判断正确的是( )
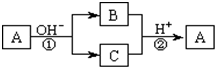
A.X元素可能为Al
B.X元素一定为非金属元素
C.反应①和②互为可逆反应
D.反应①和②不一定为氧化还原反应难度: 中等查看答案及解析
-
有一粉末由FeO和Fe3O4混合组成,取3.04g粉末加热,同时通入足量的CO使之完全反应,并用过量澄清石灰水将生成的气体充分吸收,产生沉淀5g,则FeO和Fe3O4的物质的量之比为( )
A.2:1
B.1:2
C.1:1
D.3:1难度: 中等查看答案及解析
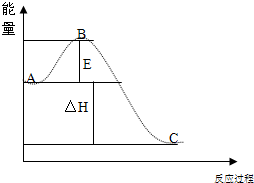

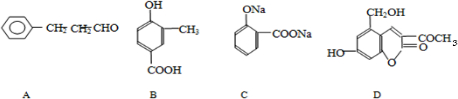
 ______、______.
______、______.