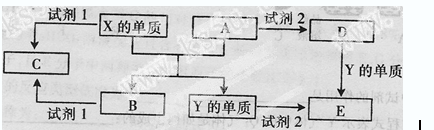
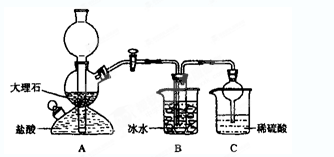
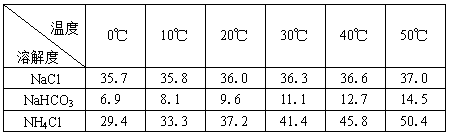
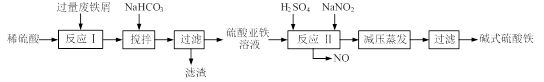
-
下列用品的有效成分及用途对应错误的是

难度: 简单查看答案及解析
-
下列判断合理的是
①硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
②蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
⑤根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
⑥根据元素原子最外层电子数的多少将元素分为金属和非金属
A.只有②⑥ B.只有②⑤ C.只有①②⑤⑥ D.只有②③④⑤
难度: 简单查看答案及解析
-
分类是化学学习与研究的常用方法,下列分类正确的是
A.Na2O、MgO、Al2O3均属于碱性氧化物
B.石灰石、生石灰、熟石灰均属于碱
C.酸、碱、盐之间发生的反应均属于复分解反应
D.混合物、分散系、胶体从属关系如右图所示

难度: 简单查看答案及解析
-
下列说法正确的是
A. Na、Fe分别与不足量的稀硫酸反应所得溶液均呈中性
B.7.8gNa2O2与CO2完全反应,转移0.2mol电子
C.能通过化合反应制得FeCl2和Fe(OH)3
D.NaHCO3、Na2CO3、(NH4)2CO3三种固体受热后均能生成气体
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO42-、CO32-
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO3-、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NH4+、I-、SCN-
D.=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
难度: 简单查看答案及解析
-
下列解释实验现象的反应方程式正确的是
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2==Na2O2
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-==Ag2S↓+2Cl-
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2===2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO3-+Ca2++2OH-===CaCO3↓+CO32-+2H2O
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O===3I2+6OH-
B.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-
NH3↑+H2O
C.将过量SO2通入冷氨水中:SO2+NH3·H2O===HSO3-+NH4+
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-===Ag++NO↑+H2O
难度: 简单查看答案及解析
-
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均能溶于水
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al
难度: 简单查看答案及解析
-
已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是
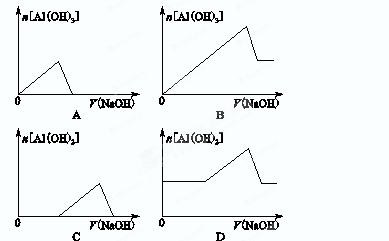
难度: 简单查看答案及解析
-
在过量的稀硫酸溶液中加入5.6 g Fe粉,待反应完全后,再加入50 mL0.5mol·L-1 KNO3溶液,恰好反应完全。该反应的方程式为:
“________FeSO4 +________KNO3 + ________H2SO4= ________K2SO4 +________Fe2(SO4)3+________NxOy + ________H2O”,则对该反应的下列说法正确的是
A.反应中还原产物是NO
B.氧化产物和还原产物的物质的量之比为1∶4
C.反应过程中转移的电子数为8e-
D.化学方程式中按物质顺序的计量数是:8、2、5、1、4、1、5
难度: 简单查看答案及解析
-
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化
A.①②③ B.②③④ C.①③④ D.①②③④
难度: 简单查看答案及解析
-
在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是
A.溶质的质量分数为
B.溶质的物质的量浓度
C.溶液中
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
难度: 简单查看答案及解析
-
0.6mol·L-1Fe2(SO4)3和1.2mol·L-1CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量为
A.0.16mol B.0.22mol C.0.30mol D.0.48mol
难度: 简单查看答案及解析
-
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是
A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液,也可以是盐酸
难度: 简单查看答案及解析
-
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
难度: 简单查看答案及解析
-
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是
A.开始加入合金的质量可能为16.4g
B.参加反应的硝酸的物质的量为0.1mol
C.生成沉淀完全时消耗NaOH溶液的体积为100mL
D.标况下产物NO的体积为22.4 L
难度: 简单查看答案及解析
-
部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+ B.V=224
C.样品中CuO的质量为4.0g D.V=448
难度: 简单查看答案及解析