-
下列反应既属于氧化还原反应,又属于吸热反应的是
A.铝片和稀盐酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.甲烷在氧气中的燃烧
难度: 简单查看答案及解析
-
下列物质属于强电解质且能导电的是
①氯化钠溶液;②氯化铵固体;③铜;④石墨;⑤熔融的NaOH;⑥稀硫酸;⑦乙酸
A.⑤ B.①②⑥ C.②⑤⑥⑦ D.①③④⑤⑥
难度: 中等查看答案及解析
-
能源分类相关图如图所示,下列四组选项中,全部符合图中阴影部分的能源

A.煤炭、石油、沼气 B.水能、生物能、天然气
C.太阳能、风能、潮汐能 D.地热能、海洋能、核能
难度: 简单查看答案及解析
-
下列说法或表示法正确的是
A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多
B.需要加热的反应说明它是吸热反应
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,若将含0.5molH2SO4的稀硫酸与含1mol NaOH的稀溶液混合,放出的热量等于57.3kJ
D.1molS完全燃烧放热297.3kJ,热化学方程式为:S+O2 =SO2 ΔH=297.3kJ·mol-1
难度: 简单查看答案及解析
-
下列有关活化分子和活化能的说法不正确的是
A.增加气体反应物的浓度可以提高活化分子百分数
B.升高温度可增加单位体积活化分子数
C.发生有效碰撞的分子一定是活化分子
D.使用催化剂可降低活化能,提高单位体积活化分子百分数
难度: 中等查看答案及解析
-
对某一可逆反应来说,使用催化剂的作用是
A.提高反应物的平衡转化率
B.改变平衡混合物中某组分的百分含量
C.增大正反应速率,减小逆反应速率
D.以同样程度改变正逆反应的速率
难度: 简单查看答案及解析
-
下列电离方程式中正确的是
A.NaHSO4溶于水:NaHSO4
Na++H++SO
B.次氯酸电离:HclO === ClO-+H+
C.HF溶于水:HF+H2O
H3O++F-
D.NH4Cl溶于水:NH+H2O
NH3·H2O+H+
难度: 简单查看答案及解析
-
室温下由水电离出的H+的浓度是1×10-12mol/L,则该溶液
A. 一定是酸性溶液 B. 一定是碱性溶液
C. 可能是中性溶液 D. 可能是酸性溶液也可能是碱性溶液
难度: 简单查看答案及解析
-
工业生产水煤气的反应为:C(s)+H2O(g)
CO(g)+H2(g) ΔH=+131.4kJ·mol-1 下列判断正确的是
A.水煤气反应中,生成1molH2(g)吸收131.4 kJ热量
B.CO(g)+H2(g)
C(s)+H2O(g) ΔH=+131.4kJ·mol-1
C.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量
D.反应物能量总和大于生成物能量总和
难度: 中等查看答案及解析
-
硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓+ H2O,下列各组实验中最先出现浑浊的是
实验
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
难度: 中等查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 18 mol/(L·min)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/( L·s)
难度: 简单查看答案及解析
-
当下列反应达到平衡时,保持温度不变,向容器中充入氩气,平衡一定不移动的是
A.N2(g)+3H2(g)
2NH3(g) B.2HI(g)
H2(g)+I2(g)
C.PCl5(g)
PCl3(g)+Cl2(g) D.2SO2(g)+O2(g)
2SO3(g)
难度: 简单查看答案及解析
-
下列关于电解质溶液的叙述正确的是
A.pH=4. 5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
B.pH相同的盐酸和醋酸溶液,加水稀释100倍后两溶液pH仍相同
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.25 ℃,将pH = 5的盐酸稀释1000倍后,溶液的pH=8
难度: 简单查看答案及解析
-
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+ H2O(g)
CO2(g) + H2(g) △H <0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是
A.增加压强 B.降低温度 C.增大CO 的浓度 D.更换催化剂
难度: 中等查看答案及解析
-
在密闭容中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
难度: 简单查看答案及解析
-
已知某可逆反应mA(g)+nB(g)
pC(g);在密闭容器中进行,下图表示在不同反应时间t、温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线,由曲线分析,下列判断正确的是
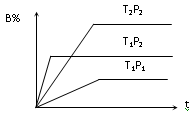
A.T1<T2、P1>P2、m+n>p,⊿H<0;
B.T1>T2、P1<P2、m+n>p、⊿H>0;
C.T1<T2、P1>P2、m+n<p,⊿H<0;
D.T1>T2、P1<P2、m+n<p、⊿H>0;
难度: 简单查看答案及解析
-
下列叙述中,不能用平衡移动原理解释的是
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深
D.黄绿色的氯水光照后颜色变浅
难度: 简单查看答案及解析
-
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)
2C(g) ΔH>0;平衡移动关系如图所示。下列说法正确的是

A.p1<p2,纵坐标指A的质量分数
B.p1>p2,纵坐标指C的质量分数
C.p1<p2,纵坐标指A的转化率
D.p1<p2,纵坐标指混合气体的平均摩尔质量
难度: 简单查看答案及解析
-
下图表示反应N2(g)+3H2(g)
2NH3(g)ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
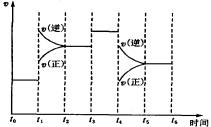
A.t0~t1 B.t2~t3
C.t3~t4 D.t5~t6
难度: 中等查看答案及解析
-
pH相同的氨水、氢氧化钠和氢氧化钡溶液,分别用蒸馏水稀释到原来的X倍、Y倍、Z倍,稀释后三种溶液的pH相同,则X、Y、Z的关系是
A.X=Y=Z B.X>Y=Z C.X<Y=Z D.X=Y<Z
难度: 中等查看答案及解析
-
1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液pH等于
A.9.0 B.9.5 C.10.5 D.11.0
难度: 中等查看答案及解析
-
当用酸滴定碱时,下列操作中会使测定结果(碱的浓度)偏低的是
A.酸式滴定管滴至终点后,俯视读数
B.碱液移入锥形瓶后,加了10 mL蒸馏水再滴定
C.酸式滴定管用蒸馏水润洗后,未用标准液润洗
D.酸式滴定管注入酸液后,尖嘴留有气泡即开始滴定,滴定终点时气泡消失
难度: 中等查看答案及解析
-
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+ H2O(g)
CO2(g) + H2(g) △H <0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是
A. 增加压强 B. 降低温度 C.增大CO 的浓度 D.更换催化剂
难度: 简单查看答案及解析
-
工业制硫酸中的反应:2SO2+O2
2SO3,等量的反应物在两个容器中反应,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若平衡时甲容器中SO2的百分含量p%,则平衡时乙容器中SO2的百分含量
A.等于p% B.大于p% C.小于p% D.无法判断
难度: 简单查看答案及解析
-
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是

A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
难度: 简单查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D.0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
难度: 中等查看答案及解析