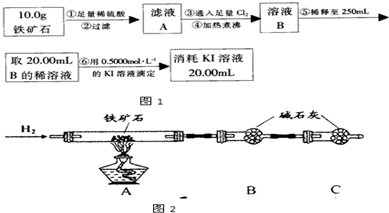
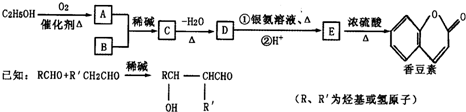
-
化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
A.氯气是合成塑料、橡胶、农药和制盐酸、有机溶剂的重要原料
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的难度: 中等查看答案及解析
-
下列关于有机物的说法中不正确的是( )
A.甲烷、苯、乙醇在一定条件下都能发生取代反应
B.烷烃和糖类分子中都存在碳碳单键
C.聚乙烯、纤维素、蛋白质都是高分子化合物
D.用新制氢氧化铜悬浊液可以鉴别乙酸、葡萄糖和淀粉三种溶液难度: 中等查看答案及解析
-
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
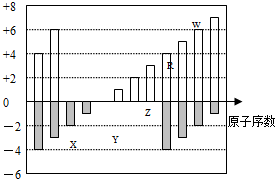
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应难度: 中等查看答案及解析
-
下列说法正确的是( )
①明矾溶于水生成Al(OH)3胶体,可除去水中的悬浮颗粒杂质
②离子化合物中阴、阳离子间只存在静电吸引力
③CH3COONa、BaSO4都是强电解质
④向Na2SiO3溶液中通入CO2至过量,溶液先变浑浊后变澄清
⑤装强碱溶液的试剂瓶需要用橡胶塞,长时间后会在瓶口有白色固体生成.
A.①④⑤
B.②③④
C.①③⑤
D.②③⑤难度: 中等查看答案及解析
-
钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X.下列说法错误的是( )
A.未知物质X为CO2,属于氧化产物
B.每转移1mol e-时,生成2mol X
C.反应中PdCl2作氧化剂,被还原
D.还原性:CO>Pd难度: 中等查看答案及解析
-
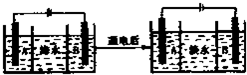
用如图所示装置进行实验,下列叙述不正确的是( )
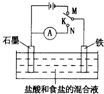
A.K与N连接时,铁被腐蚀
B.K与N连接时,石墨电极产生气泡
C.K与M连接时,一段时间后溶液的pH增大
D.K与M连接时,石墨电极反应:40H--4e-═2H2O+O2↑难度: 中等查看答案及解析
-
下列说法正确的是( )
A.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
B.浓度均为0.1mol•L-1的下列溶液,pH由大到小排列顺序为NaOH>Na2CO3>NaHSO4>(NH4)2SO4
C.pH=3的硫酸与醋酸溶液,c()与c(
)之比为1:2
D.向冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小难度: 中等查看答案及解析