-
下列说法不正确的是
A.聚乙烯是无毒高分子化合物,可用作食品包装
B.在日常生活中,电化学腐蚀是造成钢铁腐蚀的主要原因
C.推广使用新能源,可以减少二氧化碳等温室气体的排放
D.人造纤维、合成纤维和光导纤维都是有机高分子化合物
难度: 简单查看答案及解析
-
下列叙述正确的是
A.使用催化剂能够降低化学反应的反应热(ΔH)
B.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
C.SO2的水溶液能够导电,所以SO2是电解质
D.在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小
难度: 简单查看答案及解析
-
C3H6Cl2的同分异构体有几种
A.3 B.4 C.5 D .6
难度: 简单查看答案及解析
-
下列关于有机物的说法错误的是
A. CCl4可由CH4制得,可萃取碘水中的碘
B. 淀粉、油脂、蛋白质都能水解,但水解产物不同
C. 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
D. 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是Z元素形成的单质是空气的主要成分之一。已知:甲 + 乙 = 丁 + Z,甲 + 丙 = 戊 + Z; 0.1 mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
A. 原子半径:W>Z>Y>X
B. Y元素在周期表中的位置为第三周期第ⅣA族
C. 1mol甲与足量的乙完全反应共转移了1 mol电子
D. 1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.已知电离平衡常数:H2CO3>HClO>HCO,向NaClO溶液中通入少量CO22ClO-+CO2+H2O=2HClO+CO32-
B.向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br-+8H++2NO=3Br2+2NO↑+4H2O
C.在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
D.双氧水使酸性KMnO4溶液褪色:2MnO+5H2O2=2Mn2++5O2↑+6OH-+2H2O
难度: 困难查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.Cl-的结构示意图
B.铁红的化学式为Fe3O4
C.甲醛的结构简式:CH2O
D.CO2的电子式
难度: 简单查看答案及解析
-
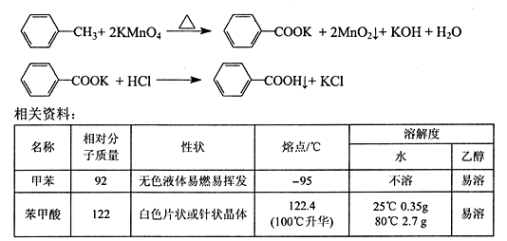
氨甲环酸和氨甲苯酸是临床上常用的止血药,其结构如下图,下列说法正确的是
氨甲环酸 氨甲苯酸
A.氨甲环酸、氨甲苯酸都能发生取代、氧化、加聚、加成等反应
B.氨甲环酸、氨甲苯酸中都有5种不同的氢原子
C.氨甲环酸与氨甲苯酸互为同分异构体
D.氨甲环酸、氨甲苯酸都能与NaOH溶液反应
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3NA
B.25℃时,pH=13的1.0 LBa(0H)2溶液中含有的OH-数目为0.2NA
C.常温常压下,4.4gCO2和N2O混合物中所含有的原子数为0.3 NA
D.1L1 mol·L-1FeCl3完全水解生成NA个胶体粒子
难度: 简单查看答案及解析
-
将0.1mol/L醋酸溶液加水稀释,下列说法正确的是
A.溶液中c(OH-)和c(H+)都减小
B.溶液的PH增大
C.醋酸电离平衡向左移动
D.溶液中c(H+)增大
难度: 简单查看答案及解析
-
室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入 盐酸体积变化曲线如下图所示。下列有关说法正确的是

A.a点由水电离出的c(H+)=1.0×10-14mol/L
B. b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)= c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
难度: 简单查看答案及解析
-
下列气体的制备和性质实验中,由现象得出的结论错误的是
选项
试剂
试纸或试液
现象
结论
A
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3为碱性气体
B
浓盐酸、浓硫酸
pH试纸
变红
HCl为酸性气体
C
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
难度: 中等查看答案及解析
-
全钒液流电池足一种新型的绿色环保储能电池。其电池总反应为:V3++VO2++H2O
VO2++2H++V2+,下列说法正确的是
A.放电时正极反应为:VO2++2H++e-=VO2++H2O
B.充电时阴极反应为:V2+-e-=V3+
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.充电过程中,H+由阴极区向阳极区迁移
难度: 困难查看答案及解析
-
CuCO3 和Cu2(OH)2CO3的混合物34.6 g,可恰好完全溶解于300mL、2 mol·L-1的盐酸溶液中,若加热分解等量的这种混合物可得CuO固体质量为
A.16.0 g B.19.2 g C.24.0 g D.30.6 g
难度: 困难查看答案及解析