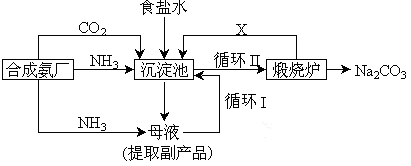
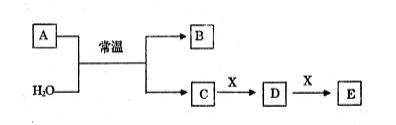
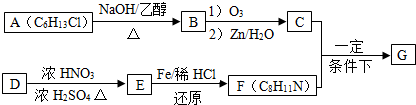
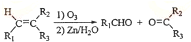
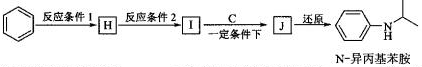
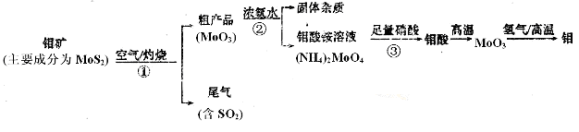
-
在“十二五”期间,山东省将大力实施“清水蓝天”工程。下列不利于“清水蓝天”工程实施的是
A.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
B.加强城市生活污水脱氮除磷处理,遏制水体富营养化
C.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
D.加大稀土资源的开采和出口,保证经济快速发展
难度: 简单查看答案及解析
-
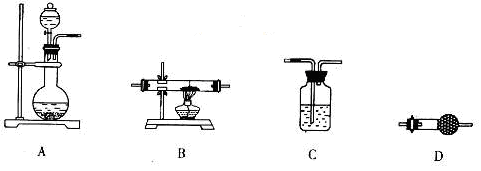
下列实验装置不能达到实验目的的是

难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
B.标准状况下,1.12L16O2和1.12L18O2均含有0.1NA个氧原子
C.0.1 mol铁在0.1 mol Cl2中充分燃烧,转移的电子数为0.3 NA
D.常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA
难度: 中等查看答案及解析
-
下列实验的现象与对应结论均不正确的是
选项
操作
现象
结论
A
将浓硫酸滴到蔗糖表面
固体变黑膨胀
浓硫酸有脱水性和强氧化性
B
将一块Al箔在酒精灯火焰上灼烧
Al箔熔融而不滴落
Al与氧气不反应
C
将一小块Na放入硫酸铜溶液中
有铜单质析出
Na能置换出硫酸铜中的铜
D
将水蒸气通过灼热的铁粉
粉末变红
铁与水在高温下发生反应
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.用石墨作电极电解氯化镁溶液:2H2O+2Cl-
-H2↑+Cl2↑+2OH-
B.用过量氨水吸收工业尾气中的SO2:2NH3·H20+SO2
2NH4++SO32-+H2O
C.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-
3Fe3++NO↑+3H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-
2BaSO4↓+Al(OH)3↓
难度: 中等查看答案及解析
-
如图W、X、Y、Z为四种物质,若箭头表示能一步转化的常见反应,其中常温下能实现图示转化关系的是
选项
W
X
Y
Z
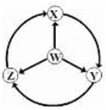
A
S
SO2
SO3
H2SO4
B
Na
Na2O2
NaOH
NaCl
C
Al
AlCl3
NaAlO2
Al2(SO4)3
D
Fe
FeCl3
Fe(OH)2
FeCl2
难度: 中等查看答案及解析
-
某同学研究铝及其化合物的性质时设计了如下两个实验方案。

NaOH溶液和稀盐酸的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是
A.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2
B.b曲线表示的是向X溶液中加入NaOH溶液
C.在O点时两方案中所得溶液的物质的量浓度相等
D.a、b曲线表示的反应都是氧化还原反应
难度: 极难查看答案及解析