-
下列说法中错误的是
A.加热一般能加快化学反应速率
B.粉碎固体物质能加快化学反应速率
C.不同物质的化学反应速率可能不一样
D.化学方程式中各物质的化学反应速率之比等于其质量比
难度: 简单查看答案及解析
-
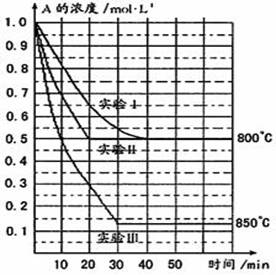
一定条件下,在2CH4(g) + 2NH3(g) + 3O2(g)
2HCN(g) + 6H2O(g)反应中,已知v (HCN) = n mol/(L·min),且v(O2) = m mol/(L·min),则m与n的关系正确的是
A.
B.
C.
D.m = 2n
难度: 简单查看答案及解析
-
在一定温度下,反应A2(g)+B2(g)
2AB(g)达到平衡状态的标志是
A.单位时间内生成n molA2,同时生成n molAB
B.容器内混合气体的平均相对分子质量不随时间变化
C.单位时间内生成2n molAB,同时生成n molB2
D.单位时间内一个A-A键断裂,同时生成二个A-B键
难度: 简单查看答案及解析
-
下列说法正确的是
A.需要加热方能发生的反应一定是吸热反应 B.放热的反应在常温下一定很容易发生
C.物质发生化学反应一定伴随着能量变化 D.凡是吸热或放热过程中热量的变化均称为反应热
难度: 简单查看答案及解析
-
在一定温度下,反应:2A (s)+2B(g)
C(g)+D (g)在恒容容器中进行,不能说明该反应已经达到平衡的是
A.容器内的压强不随时间而变化 B.混和气体的密度不随时间而变化
C.A的质量不再变化 D.平衡混和气体的平均相对分子质量不再改变
难度: 简单查看答案及解析
-
两个极易导热的密闭容器A和B,容器A容积恒定,容器B容积可变,在温度压强和起始体积相同的条件下往A和B中分别充入等物质的量的NO2,发生反应2NO2
N2O4 △H<0,以下说法正确的是
A.反应起始时,两容器中的反应速率关系是v(A)<v(B)
B.反应过程中,两容器内的反应速率关系为v(A)<v(B)
C.两容器内的反应达到平衡所需时间一定相同
D.反应达到平衡时,两容器内的压强关系是p(A)>p(B)
难度: 简单查看答案及解析
-
在密闭容器中,一定条件下,进行如下反应:2NO(g) +2CO(g)
N2 (g) +2CO2 (g) △H<O,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
难度: 简单查看答案及解析
-
某恒温恒容的容器中,建立如下平衡:2A(g)
B(g),在相同条件下,若分别再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时
A.都增大 B.都减小 C.前者增大后者减小 D.前者减少后者增大
难度: 简单查看答案及解析
-
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H1 = -Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H2= -Q2 KJ/mol
2H2(g)+O2(g)==2H2O(l) △H3 = -Q 3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是
A.放出的热量为(0.4 Q 1+0.05 Q 3)KJ/mol B.放出的热量为(0.4 Q 1+0.05 Q 2)KJ/mol
C.△H2 = △H3 D.△H2 <△H3
难度: 简单查看答案及解析
-
反应aX(g)+bY(g)
cZ(g), 在不同的温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nZ)与反应时间(t)的关系如图所示。下列判断不正确的是

A.T1<T2 B.反应热△H<0 C.P1>P2 D.a+b>c
难度: 简单查看答案及解析
-
以NA代表阿伏加德罗常数的数值,则关于热化学方程式:
C2H2 ( g ) +5/2O2 ( g ) ==2CO2 ( g )+H2O ( l ) △H = -1300kJ / mol 的说法中,正确的是
A.当10 NA个电子转移时,该反应放出1300kJ的能量
B.当1 NA个水分子生成且为液体时,吸收1300kJ的能量
C.当2 NA个碳氧共用电子对生成时,放出1300kJ的能量
D.当8 NA个碳氧共用电子对生成时,放出1300kJ的能量
难度: 简单查看答案及解析
-
下列各图是温度T(或压强P)对f反应2A(s) + 2B(g)
2C(g) + D(g) △H>0的正、逆反应速率的影响,曲线交点表示建立平衡时的温度或压强,其中正确的是

难度: 简单查看答案及解析
-
在高温下,反应2HBr(g)
H2(g)+Br2(g) △H>0, 达到平衡,要使混合气体颜色加深,可采取的方法是
A.减小压强 B.缩小体积 C.升高温度 D.增大氢气浓度
难度: 简单查看答案及解析
-
已知反应2A(g)
B(?)+ 2C(?) △H>0,满足如图所示的关系,则下列说法中正确的是
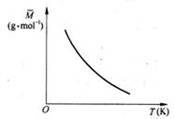
A.B、C可能均为非气态
B.若B是气态,则C一定也只能是气态
C.若B为固态,则C一定为气态
D.B、C可能均是气态
难度: 简单查看答案及解析