-
“民以食为天”在新时代已拓展了新含义,那就是保障食品安全——“食以安为先”。下列食品、调味品的制作过程中,没有发生化学变化的是

难度: 简单查看答案及解析
-
化学与环境、生活、科研息息相关,下列说法错误的是
A.双氧水稀溶液可用于清洗伤口
B.14C常用于文物年代的鉴定,14C和12C互为同位素
C.PM2.5颗粒(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶
D.自来水厂可使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.硫的原子结构示意图:

B.NH4Br的电子式:
C.Be2+离子中的质子数和电子数之比为2:1
D.中子数为146、原子序数为92的铀(U)原子:
难度: 简单查看答案及解析
-
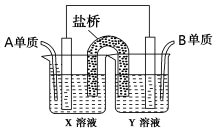
常温下,下列各组离子在指定溶液中一定能大量共存的是

难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数,下列说法正确的是
A.标准状况下,6.72LNO2与水充分反应转移电子数为0.1NA
B.18gD2O中含有的质子数目为10NA
C.常温常压下,1mol氦气中含有的核外电子数为2NA
D.ag某气体含分子数为b,cg该气体在标况下的体积为22.4ab/(c NA) L。
难度: 中等查看答案及解析
-
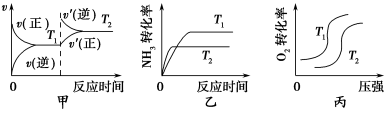
对可逆反应4NH3(g)+ 5O2(g)
4NO(g)+ 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
难度: 中等查看答案及解析
-
下列实验“操作和现象”与“目的或结论”对应关系正确的是
操作和现象
目的或结论
A
向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成
该溶液中一定含有SO42-
B
向铁和稀硝酸反应后的溶液中若滴加KSCN溶液显红色;若滴加酸性高锰酸钾溶液紫红色褪去
该溶液中既有Fe3+,还有Fe2+
C
将铁插入硫酸铜溶液中
比较Cu、Fe2+的还原性
D
将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液
检验碳与浓硫酸反应后的气体产物
难度: 中等查看答案及解析
-
在15.2g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成气体X,再向所得溶液中加入足量的NaOH溶液,生成25.4g沉淀,则下列表示气体X组成的选项中合理的是
A.0.3 mol NO、0.1 mol NO2
B.0.3 mol NO2、0.1 mol NO
C.0.6 mol NO
D.0.3 mol NO2
难度: 中等查看答案及解析
-
已知:2H2(g) +O2(g) = 2H2O(g) ΔH =-483.6 kJ/mol


下列说法不正确的是
A.H2(g) 中的H—H 键比 H2O(g) 中的H—O 键牢固
B.H2O(g)=H2(g) + 1/2O2(g) ΔH = +241.8 kJ/mol
C.破坏1 mol H—O 键需要的能量是463.4 kJ
D.H2(g) + 1/2O2(g)=H2O(l) ΔH <-241.8 kJ/mol
难度: 简单查看答案及解析
-
下列解释事实或实验现象的化学用语正确的是
A.向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
Fe(OH)3↓+ 3H+
B.酸性KI淀粉溶液久置后变蓝4I-+O2+2H2O=2I2+4OH-
C.实验室盛装NaOH溶液的试剂瓶不能用玻璃塞 SiO2 +2OH- = SiO32-+H2O
D.钢铁表面的水膜酸性较强时,水膜中的H+会被还原O2+4H++4e- = 2H2O
难度: 中等查看答案及解析
-
下列图示与对应的叙述一定正确的是
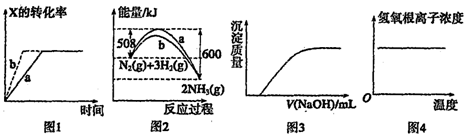
A.图1所示反应:X(g)+Y(g)
2Z(g),b的压强一定比a大
B.图2表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
C.图3表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量变化
D.图4表示明矾溶液受热时氢氧根浓度随温度的变化
难度: 中等查看答案及解析
-
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是

A.A、B的单质与稀盐酸反应速率B>A
B.D、E形成的简单离子的还原性E->D-
C.气态氢化物的稳定性HD<H2C
D.最高价氧化物对应的水化物的酸性 H2CO4>HEO4
难度: 困难查看答案及解析
-
铝是一种很重要的金属,可以发生一系列反应制备物质。

下列说法错误的是
A.反应①又称铝热反应,曾用于野外焊接铁轨
B.利用反应②③都能产生氢气,且产生等量氢气消耗Al的质量和转移电子数分别相等
C.反应①②中铝均作还原剂
D.常用反应⑥制备Al(OH)3,方法是向Al2(SO4)3溶液中滴加NaOH溶液至恰好完全沉淀
难度: 中等查看答案及解析
-
根据表中信息判断,下列选项不正确的是
序号
反应物
产物
①
KMnO4、H2O2、H2SO4
K2SO4、MnSO4
②
Cl2、FeBr2
FeCl3、FeBr3
③
MnO4-
Cl2、Mn2+
A.氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2
B.第①组反应的氧化产物为O2
C.第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2
D.第③组反应中生成1mol Cl2,转移电子2mol
难度: 中等查看答案及解析