-
选修四化学反应原理主要研究:化学反应进行的方向、快慢、程度以及反应过程中能量转化等内容。下列有关说法错误的是( )
A.化学变化中,遵循能量守恒,所谓吸热反应可看作把环境中的能量储存到了物质中
B.化学变化中,各种原子的数目是恒定的,所谓资源匮乏只是元素的分布发生了变化
C.氧化还原反应都是放热反应
D.强酸和强碱的中和反应的活化能接近于零,所以反应速率很高
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及实验目的都正确的是( )
选项
目的
实验
现象
A
检验CO2气体中混有SO2
将气体通入盛有足量的澄清石灰水中的洗气瓶中
石灰水变浑浊
B
检验黑色固体Fe3O4中含有+3价铁元素
将少量黑色固体加入盛有KSCN溶液的烧杯中
固体溶解,溶液呈血红色
C
验证氧化性:Fe3+>Cu2+
将一定量铜粉加到盛有一定体积的1.0mol•L﹣1Fe2(SO4)3溶液的试管中
铜粉溶解,溶液变蓝色
D
比较氯和碳的非金属性强弱
将碳酸钠溶液中滴入稀盐酸
有气泡产生
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加罗常数的值,下列说法正确的是( )
A. 298K、101kPa时,22.4L CO2所含的原子数为3NA
B. 0.5mol C2H2和C6H6的气态混合物中所含原子总数为2NA
C. 2L 1mol/L的盐酸中所含HCl分子数约为2NA
D. 1mol Cl2与足量的Fe完全反应,转移的电子数为2NA
难度: 简单查看答案及解析
-
宋代著名法医学家宋慈的《洗冤集录》中有银针验毒的记载,“银针验毒”涉及的化学反应是 4Ag + 2H2S + O2 → 2X + 2H2O,下列说法正确的是( )
A. X的化学式为AgS B. 银针验毒时,空气中氧气失去电子
C. 每生成1mo1X,反应转移2mo1 电子 D. 反应中Ag和H2S均是还原剂
难度: 中等查看答案及解析
-
HCl、Na2O2、Al2O3 三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl-、OH-;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为( )
A. 3:2:1 B. 2:3:1 C. 4:2:1 D. 2:4:1
难度: 中等查看答案及解析
-
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
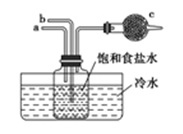
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3然后a通入CO2,c中放碱石灰
C.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
D.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
难度: 中等查看答案及解析
-
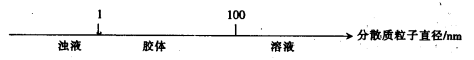
将某些化学知识用数轴表示,可以收到直观、简明、易记的效果。用数轴表示的下列知识正确的是( )
A.硫及其化合物的化合价与氧化还原反应的关系:

B.分散系的分类:
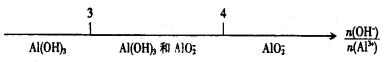
C.AlCl3溶液与NaOH溶液反应后铝元素的存在形式:
D.CO2与NaOH溶液反应后的产物
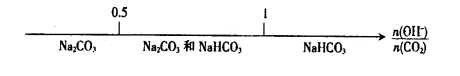
难度: 困难查看答案及解析
-
下列叙述中正确的是( )
A. 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
B. 液溴易挥发,在存放液溴的试剂瓶中应加水封
C. 某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D. 某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+
难度: 中等查看答案及解析
-
海带中提取碘的实验方法:①称取3 g干海带,用刷子把干海带表面的附着物刷净;②将海带剪碎,用酒精润湿(便于灼烧)后,放在坩埚中;③用酒精灯灼烧盛有海带的坩埚,至海带完全成灰,停止加热,冷却;④将海带灰转移到小烧杯中,再向烧杯中加入10 mL蒸馏水,搅拌,煮沸2~3 min,使可溶物溶解,过滤;⑤向滤液中滴入几滴硫酸,再加入约1 mL H2O2溶液,观察现象。下列说法正确的是
A. 步骤①中也可以用水洗涤除去海带表面的附着物
B. 步骤④过滤操作需要两种玻璃仪器
C. 通过以上①~⑤步骤即可得到纯度高的I2
D. 步骤⑤所得的溶液中加入淀粉可看到溶液变为蓝色
难度: 中等查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W< X<Z B. 气态氢化物的热稳定性:W<Y
C. W与X形成的化合物溶于水后溶液呈碱性 D. 最高价氧化物的水化物的酸性:Y>Z
难度: 中等查看答案及解析
-
有关化学用语的表示正确的是( )
A. 甲烷分子的比例模型是
B. HClO的结构式为H—O—Cl
C. 二氧化碳的电子式:
D. Cl—的结构示意图为:
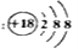
难度: 中等查看答案及解析
-
关于下列图象及其相关说法正确的是( )
图①:
 图②:
图②:
图③:
 图④ :
图④ :
A.据图①可判断:2O3(g)=3O2(g);△H= - 44.8KJ/mol
B.据图②可判断:某反应在使用催化剂时比无催化剂时反应速率大,且面积Saco>Sbdo
C.据图③可判断: 2O2(g)═O3(g)+O(g)△H>0
D.据图④可判断:2NO2(g)+O3(g)
N2O5(g)+O2(g),0~3s内,反应速率为V(N2O5)=0.2mol·L-1·S-1
难度: 困难查看答案及解析
-
下列说法正确的是
A. 活化分子之间的碰撞即为有效碰撞
B. 增大压强不能降低活化能,但能增加活化分子百分数
C. 活化能的大小决定了反应能否自发进行
D. 使用催化剂能降低活化能,增加活化分子百分数
难度: 简单查看答案及解析
-
标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图中曲线所示。下列分析正确的是
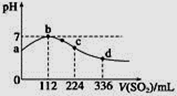
A. 氢硫酸的酸性比亚硫酸的酸性强
B. 原H2S溶液的物质的量浓度为0.05 mol·L-1
C. a点对应溶液的导电性比d点强
D. b点水的电离程度比c点水的电离程度大
难度: 简单查看答案及解析
-
醋酸钡晶体[(CH3COO)2Ba•H2O]是一种媒染剂,易溶于水.下列有关0.1mol•L-1醋酸钡溶液中粒子浓度关系的表示中,错误的是( )
A.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
D.c(H+)=c(OH-) -c(CH3COOH)
难度: 困难查看答案及解析
-
下列关于如图所示电化学装置的分析正确的是( )

A. 若X为直流电源,Y为碳棒接负极,则Fe棒被保护
B. 若X为电流计,Y为锌棒,则SO42-移向Fe棒
C. 若X为导线,Y为铜棒,则Fe棒发生还原反应
D. 若X为直流电源,Y为铜棒接正极,则Fe棒上有铜析出
难度: 中等查看答案及解析
-
已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A. (2b+2c-a) kJ·mol-1 B. (b+c-a) kJ·mol-1
C. (a-2b-2c) kJ·mol-1 D. (a-2b-c) kJ·mol-1
难度: 简单查看答案及解析
-
将CO2转化为甲醇的原理为CO2(g)+3H2(g)
CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )

A. 曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B. 从反应开始到10min时,H2的反应速率υ(H2)=0.225 mol/(L·min)
C. 500 ℃时该反应的平衡常数K=3
D. 平衡时H2 的转化率为75%
难度: 中等查看答案及解析
-
25℃时,0.1 mol/L下列溶液的pH如下表,有关比较正确的是( )
序号
①
②
③
④
⑤
溶液
NaCl
CH3COONH4
NaClO
NaHCO3
Na2CO3
pH
7.0
7.0
10.3
8.3
11.6
A. 酸性的相对强弱:HClO<HCO3-
B. 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L
C. 由水电离产生的c(H+):① = ②
D. 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-)
难度: 简单查看答案及解析
-
下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为
CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
C.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol,则H2SO4和Ca(OH)2反应的中和热
ΔH=2×(-57.3)kJ·mol-1
D.500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ·mol-1
难度: 中等查看答案及解析


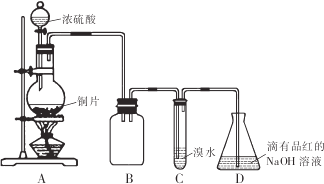
 (1)贝壳的主要化学成分为________________(写化学式).
(1)贝壳的主要化学成分为________________(写化学式).