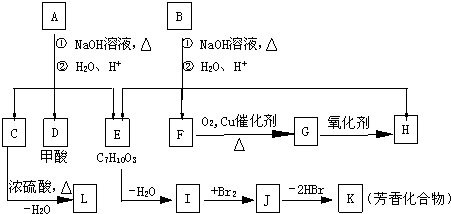
-
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol•L-1,则此溶液最多溶解铁粉的质量为( )
A.5.6g
B.11.2g
C.22.4g
D.33.6g难度: 中等查看答案及解析
-
下列各组离子,在所给条件下能够大量共存的是( )
A.pH=0的溶液中:Fe3+、Mg2+、Cl-、SO42-
B.水电离出的c(H+)=1×10-12mol/L的溶液中:K+,HCO3-,Cl-,S2-
C.使pH试纸显深蓝色的溶液中:Cu2+,Fe3+,NO3-,SO42-
D.在AlCl3溶液中:Na+,AlO2-,SO42-,NO3-难度: 中等查看答案及解析
-
短周期元素X、Y、Z的离子具有相同的核外电子排布,离子半径Y大于Z,Y与Z可形成常见的离子化合物,原子半径X大于Z,则下列说法中不正确的是( )
A.原子序数一定是Z>X>Y
B.X、Z两种元素的单质的沸点一定是Z>X
C.Z的最高价氧化物一定能溶于X、Y的最高价氧化物的水化物
D.工业上获得X、Z单质的方法主要是电解难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的乙烯和一氧化碳所含的分子数必相等
C.1L一氧化碳气体一定比1L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等难度: 中等查看答案及解析
-
下列物质中不能通过置换反应生成的是( )
A.F2
B.CO
C.Fe3O4
D.S难度: 中等查看答案及解析
-
对0.1mol•L-1的醋酸溶液进行以下操作,下列分析判断正确的是( )
A.加入少量0.1mol•L-1的硫酸,水电离产生的c(H+)减小
B.升高温度,溶液的pH会增大
C.加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+)
D.与0.1mol•L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+)难度: 中等查看答案及解析
-
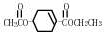
心炯胺是治疗冠心病的药物.它具有如图结构简式.下列关于心炯胺的描述,错误的是( )
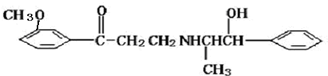
A.可以在催化剂作用下和溴反应
B.可以和银氨溶液发生银镜反应
C.可以和氢溴酸反应
D.可以和浓硫酸与浓硝酸的混合液反应难度: 中等查看答案及解析
-
向足量H2SO4溶液中加入100mL 0.4mol•L-1 Ba(OH)2溶液,放出的热量是5.12kJ.如果向足量Ba(OH)2溶液中加入100mL 0.4mol•L-1 HCl溶液时,放出的热量为2.2kJ.则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
A.Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-2.92kJ•mol-1
B.Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-0.72kJ•mol-1
C.Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-73kJ•mol-1
D.Ba2+(aq)+SO42-(aq)=BaSO4(s)△H=-18kJ•mol-1难度: 中等查看答案及解析
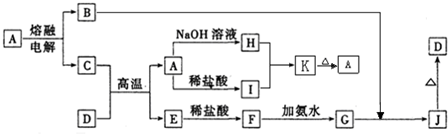
 .
.