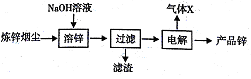
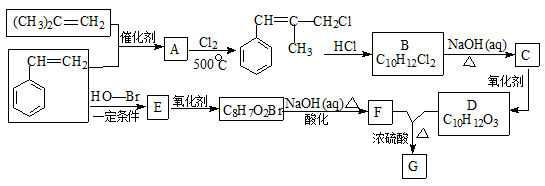
-
化学与生活、社会发展息息相关。下列说法不正确的
A. 黑火药由硝石、硫磺,木炭按一定比例混合制成,其中”硝石”指的硝酸钾
B. “青蒿一握,以水二升渍,绞取汁”,该提取青蒿素的过程属于化学变化
C. “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合反应
D. 侯氏制碱法的工艺过程中应用了物质溶解度的差异
难度: 简单查看答案及解析
-
已知
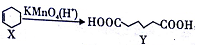 ,下列说法错误的是
,下列说法错误的是A. X分子中所有碳原子一定在同一平面上
B. X与乙烯不属于同系物
C. Y可发生取代反应、氧化反应
D. Y的含有相同官能团的同分异构体有8种(不考虑立体异构)
难度: 中等查看答案及解析
-
下列有关100 mL 0.lmol·L-1 (NH4)2Fe(SO4)2溶液的叙述正确的是
A. 与K+、Na+、AlO2-、CO32-可以大量共存
B. 可用铁氰化钾溶液检验该溶液是否变质
C. 与100mL 0.1mol/L Ba(OH)2反应的离子方程式:Ba2++2OH-+SO42-+2NH4+=BaSO4↓+2NH3·H2O
D. 与足量酸性KMnO4溶液混合充分反应,共转移电子0.01mol
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确是
A. 44g CO2和N2O的混合物中含有的氧原子数为1.5NA
B. 2L 0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA
C. 0.5mol CH5+中含有的电子数目为5NA
D. 常温下,1L 0.5 mol/L Ba(OH)2溶液中水电离的OH-个数为0.1NA
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X最外层电子数是次外层2倍,Y是非金属性最强的元素,Z原子半径在同周期元素中最大,W可与Z形成离子化合物Z2W。下列说法正确的是
A. 四种元素在自然界均不能以游离态存在
B. X、Z、W均可形成两种常见氧化物
C. 元素X、Y、W的最高化合价均与其族序数相等
D. 离子半径:W>Z>Y
难度: 中等查看答案及解析
-
根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作
现象
实验结论
A
用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中
出现白色沉淀
H2CO3的酸性比H2SiO3的酸性强
B
向某溶液先滴加硝酸酸化,再滴加BaCl2溶液
有白色沉淀生成
原溶液中含有SO42-、SO32-、HSO3-中的一种或几种
C

试管b比试管a中溶液的红色深
增大反应物浓度,平衡向正反应方向移动
D
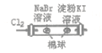
左边棉球变为橙色,右边棉球变为蓝色
氧化性:Cl2>Br2>I2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列说法中不正确的是
A. 等浓度的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32-)+c(OH-) +c(HCO3-)
B. pH相同的盐酸和醋酸,分别用蒸馏水稀释至原体积的m倍和n倍稀释后两溶液pH 相等,则m>n
C. 常温下,0.1mol/L某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数为10-7
D. 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图。由图可知:Ksp[Fe(OH)3]2]
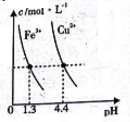
难度: 中等查看答案及解析