-
下列说法不正确的是
A.正常雨水的pH为7.0,酸雨的pH小于7.0
B.严格执行机动车尾气排放标准有利于防止大气污染
C.使用二氧化硫和某些含硫化合物漂白食品会对人体健康产生危害
D.PM 2.5是指大气中直径≤2.5微米的颗粒物,戴普通口罩还是对人体健康有影响
难度: 中等查看答案及解析
-
下列气体不能用浓硫酸作干燥剂的是
①HCl ②NH3 ③Cl2 ④H2 ⑤SO2 ⑥HI
A.①②⑥ B.②⑤⑥ C.①⑥ D.②⑥
难度: 中等查看答案及解析
-
常温下,能促进水的电离的物质是
A.醋酸 B.NaOH溶液 C.Na2CO3溶液 D.硫酸
难度: 中等查看答案及解析
-
可用一种试剂鉴别KCl、Ba(OH)2、Na2CO3、K2SO3 四种溶液,该试剂是
A.BaCl2 B.H2SO4 C.KOH D.HCl
难度: 中等查看答案及解析
-
下列事实中,能用勒夏特列原理解释的是
A.对于反应2HI(g)
H2(g)+I2(g),增大平衡体系的压强(压缩体积),可使体系颜色变深
B.实验室常用排饱和食盐水法收集氯气
C.硫酸工业中,加催化剂有利于三氧化硫的生成
D.2SO2 + O2
2SO3的反应条件不是室温,是500℃左右
难度: 中等查看答案及解析
-
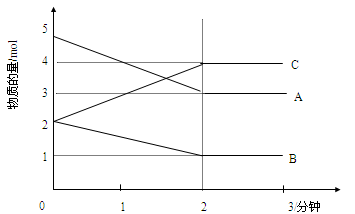
在温度不变的条件下,在恒容的容器中进行下列反应:N2O4(g)
2NO2(g),若N2O4的浓度由0.1mol/L降到0.07mol/L时,需要15 s,那么N2O4的浓度由0.07mol/L降到0.05mol/L时,所需反应的时间为
A.等于5s B.等于10s C.大于10s D.小于10s
难度: 中等查看答案及解析
-
下列说法正确的是
A.紫色石蕊试液中通入二氧化硫,溶液先变红后褪色
B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化
C.硫粉在过量的纯氧中燃烧可以生成大量的SO3
D.富含硫黄的矿物在工业上可用于制造硫酸
难度: 中等查看答案及解析
-
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液,则灯泡由亮变暗至熄灭,后又逐渐变亮的是
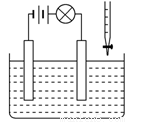
A.盐酸中逐滴加入食盐溶液
B.硫酸中逐滴加入NaOH溶液
C.硫酸中逐滴加入Ba(OH)2溶液
D.硫酸铜溶液中逐滴加入NaOH溶液
难度: 中等查看答案及解析
-
设NA是阿伏加德罗常数的数值,下列说法正确的是
A.1molAl3+离子含有的核外电子数为3NA
B.1molCl2与足量的铁反应,转移的电子数为3NA
C.10LpH=1的硫酸溶液中含有的H+离子数为2NA
D.10LpH=13的NaOH溶液中含有的OH-离子数为NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.硝酸银溶液与铜:Cu+Ag+ → Cu2++Ag
B.氧化铜与盐酸反应:O2-+2H+ → H2O
C.碳酸钡与盐酸:CO32-+2H+ → H2O+CO2↑
D.Cu(OH)2加入H2SO4:2H++Cu(OH)2 → Cu2+ +2H2O
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
①澄清透明溶液中:K+、Na+、MnO
、SO
②石蕊呈蓝色的溶液中:Na+、Al3+、NO
、HCO
③在pH=1的溶液中:Fe3+、NO
、F -、Na+
④含大量OH-的溶液中:CO
、Cl-、F-、K+
⑤在pH=0的溶液中:Na+、NO
、SO
、K+
⑥常温下
=1012的溶液中: Na+、Al3+、NO
、Cl-
A.①③④⑤ B.④⑥ C.①④⑥ D.④⑤⑥
难度: 困难查看答案及解析
-
下列示意图中,正确的是

A.图①表示烧碱溶液中滴加稀醋酸 B.图②表示稀醋酸加水稀释
C.图③表示镁与一定量的盐酸反应 D.图④表示加热纯碱溶液
难度: 中等查看答案及解析
-
向一体积为2L的恒容密闭容器里充入1 mol N2和4 molH2,在一定温度下发生反应:
N2(g)+3H2(g)
2NH3(g)+Q (Q > 0)
10秒后达到平衡,c(NH3)为0.4mol/L。下列说法正确的是
A.该反应达平衡时H2的转化率为40%
B.降低温度能使混合气体的密度增大
C.向该容器中充入N2,平衡正向移动
D.研发高效催化剂可大大提高N2的转化率
难度: 中等查看答案及解析
-
在密闭容器中发生如下反应:aX(g)+bY(g)
cZ(g)+dW(g),反应达平衡后,W的浓度为0.5mol•L-1,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为0.8mol•L-1。下列叙述不正确的是
A.平衡向逆反应方向移动 B.a+b > c+d
C.Z的体积分数减少 D.X的转化率减小
难度: 中等查看答案及解析
-
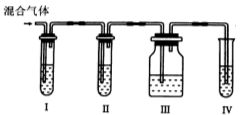
在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)
CO2(g)+H2(g)+Q(Q>0),下列对图像的分析中不正确的是

A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是压强对化学平衡的影响,且乙压强大于甲
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
难度: 中等查看答案及解析
-
已知:某元素X的酸式盐(NaHX)溶液显碱性,下列说法正确的是
A.NaHX的电离方程式为 NaHX → Na+ + H+ + X2¯
B.HX ¯的电离程度小于HX ¯的水解程度
C.离子浓度关系:c(Na+) + c(H+) = c(OH¯) + c(HX¯) + c(X2¯)
D.加水稀释,促进HX¯水解,c(HX ¯ )增大
难度: 中等查看答案及解析
-
现有CuO、FeO、Fe2O3组成的混合物m g,向其中加入100mL 1mol·L-1硫酸,恰好完全溶解,若m g该混合物在过量氢气流中加热充分反应,则冷却后剩余固体的质量为
A.(m-0.8)g B.(m-1.2)g C.(m-1.6)g D.无法计算
难度: 中等查看答案及解析
-
将一定量的铁粉和硫粉的混合物共热,充分反应后冷却,再加入足量的稀硫酸,得到标准状况下的气体11.2 L。则原混合物可能的组成是
A.n(Fe) < n(S), 总质量等于44 g B.n(Fe) > n(S), 总质量小于44 g
C.n(Fe) = n(S), 总质量大于44 g D.n(Fe) > n(S), 总质量等于44 g
难度: 中等查看答案及解析