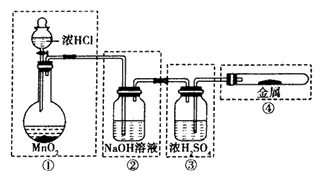
-
某有机物分子式为C4H8,下列有关说法正确的是
A. 其一氯代物可能只有一种
B. 其分子中的共面原子最多6个
C. 可用催化加氢反应除去C4H10中的C4H8
D. 等质量的CH4和C4H8分别在氧气中完全燃烧,耗氧量CH4少于C4H8
难度: 中等查看答案及解析
-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项
现象或事实
解释
A
光线透过树叶间的缝隙射入密林中时,会产生一道道光柱
气溶胶产生的丁达尔效应
B
炒菜时加碘盐要在菜准备出锅时添加
食盐中的碘受热易升华
C
明矾常用作净水剂
明矾具有杀菌消毒功能
D
用浸泡过高锰酸钾溶液的硅藻土保鲜水果
水果中的葡萄糖能与高锰酸钾发生氧化还原反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
A是中学化学中常见的单质,B、C为化合物。它们有如图所示的转化关系(部分产物及反应条件省略)。下列判断正确的是
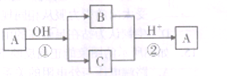
A. A可能是金属,也可能是非金属
B. A、B、C含有一种相同的元素
C. B、C的水溶液一定都呈碱性
D. 反应①②不一定都是氧化还原反应
难度: 困难查看答案及解析
-
工业上可利用下图所示电解装置吸收和转化SO2(A、B均为惰性电解)。下列说法正确的是
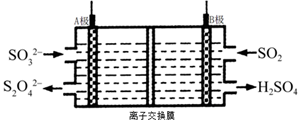
A. B电极为电解池的阴极
B. B极区吸收5molSO2,则A极区生成2.5molS2O42-
C. B极区电解液为稀硫酸,电解一段时间后硫酸浓度增大
D. A电极的电极反应为:2SO32--2e-+4H+=S2O42-+2H2O
难度: 困难查看答案及解析
-
有机物甲、乙的键线式结构如图所示。下列说法不正确的是
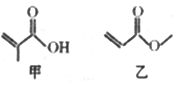
A. 甲和乙互为同分异构体
B. 甲和乙都能发生取代反应
C. 甲和乙中都有3种不同化学环境的氢
D. 1mol甲和1mol乙都能与2molH2发生加成反应
难度: 中等查看答案及解析
-
下列实验“操作和现象”与“结论”的对应关系正确的是
操作和现象
A
向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体
HNO3分解生成了NO2
B
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成
淀粉没有水解生成葡萄糖
C
向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊
析出了NaHCO3
D
向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KmnO4溶液,溶液红色褪去
使酸性KmnO4溶液褪色的气体只有乙烯
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
硝酸越稀还原产物中氮元素的化合价越低。某同学取铁铝合金与足量很稀的硝酸充分反应没有气体放出。在反应后的溶液中逐渐加入4mol·L-1NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示(不考虑沉淀的微量溶解)。下列说法不正确的是
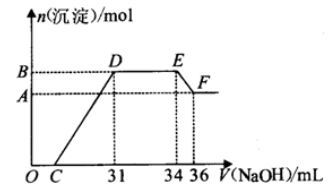
A. D点溶液中存在:c(NH4+)+c(Na+)+c(H+)=c(OH-)+c(NO3-)
B. EF段发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O
C. D点溶液中n(NH4+)=0.012mol
D. 由水电离产生的c(H+):O点>F点
难度: 困难查看答案及解析