-
已知Ca(OH)2的溶解度随温度升高而降低.将40℃的饱和澄清石灰水冷却至10℃,或保持40℃向其中加入少量CaO,两种情况下均保持不变的是( )
A.溶液中Ca2+的数目
B.溶剂的质量
C.溶液中溶质的物质的量浓度
D.溶质的质量难度: 中等查看答案及解析
-
已知单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点就越高.则下列溶液的沸点最高的是( )
A.0.01mol/L的蔗糖溶液
B.0.01mol/L的CaCl2溶液
C.0.02mol/L的NaCl溶液
D.0.02mol/L的CH3COOH溶液难度: 中等查看答案及解析
-
下列各组中两种气体所含的原子数一定相等的是( )
A.质量相等、密度不等的N2和CO
B.温度相同、体积相同的O2和N2
C.体积相等、密度相等的CO和C2H4
D.压强相同、体积相同的N2和O2难度: 中等查看答案及解析
-
两份体积相同的某植物营养液,其配方如下:
两种营养液的成分( )含量 KCl K2SO4 ZnSO4 ZnCl2 ① 0.3mol 0.2mol 0.1mol - ② 0.1mol 0.3mol - 0.1mol
A.n(K+)相同
B.n(Cl-)相同
C.完全相同
D.完全不同难度: 中等查看答案及解析
-
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应.下列判断正确的是(不考虑NO2转化为N2O4)( )
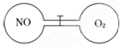
A.开始时左右两室分子数相同
B.反应前后NO室压强相同
C.最终容器内密度与原来相同
D.最终容器内无O2存在难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.16 g CH4中含有4NA个C-H键
B.1 mol•L-1 NaCl溶液含有NA个Na+
C.1 mol Cu与足量稀硝酸反应产生NA个NO分子
D.常温常压下,22.4 L CO2中含有NA个CO2分子难度: 中等查看答案及解析
-
将0.01mol下列物质分别加入100mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2②Na2O③Na2CO3④NaCl( )
A.①>②>③>④
B.①>②>④>③
C.①=②>③>④
D.①=②>③=④难度: 中等查看答案及解析
-
在200mL某硫酸盐溶液中含有1.5NA个硫酸根离子(NA表示阿伏加德罗常数),同时含有NA个金属阳离子,则该硫酸盐的物质的量浓度为( )
A.1mol•L-1
B.2.5mol•L-1
C.5mol•L-1
D.2mol•L-1难度: 中等查看答案及解析
-
把VL含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡.则原混合溶液中钾离子的浓度为( )
A.mol•L-1
B.mol•L-1
C.mol•L-1
D.mol•L-1
难度: 中等查看答案及解析
-
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol•L-1稀盐酸.下列图象能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A.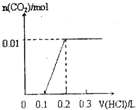
B.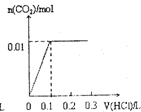
C.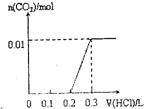
D.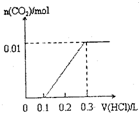
难度: 中等查看答案及解析
-
一定条件下磷与干燥氯气反应,若0.25g磷消耗掉314mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于( )
A.3:1
B.5:3
C.2:3
D.1:2难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L二氯甲烷的分子数约为NA个
B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5 mol
C.17.6 g丙烷中所含的极性共价键为4NA个
D.电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g难度: 中等查看答案及解析
-
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则原混合溶液中钾离子物质的量浓度为( )
A.0.1(b-2a)mol/L
B.10(2a-b)mol/L
C.10(b-a)mol/L
D.10(b-2a)mol/L难度: 中等查看答案及解析
-
现有铝和过氧化钠的固体混合物样品,加入稀盐酸使混合物完全溶解,所得溶液中c(Al3+):c(H+):c(Cl-)=1:2:8,则原固体混合物中铝元素与氧元素的质量比为( )
A.3:4
B.9:32
C.9:16
D.9:8难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.常温常压下的33.6 L氯气与27 g铝充分反应,转移电子数为3NA
B.标准状况下,22.4 L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中氧原子数为2NA
D.1 L浓度为1 mol•L-1的Na2CO3溶液中含有NA个难度: 中等查看答案及解析
-
在一定条件下,完全分解下列某化合物2g,产生氧气1.6g,此化合物是( )
A.1
B.2
C.1
D.2难度: 中等查看答案及解析
-
向某HNO3和Fe(NO3)3的混合稀溶液中逐渐加入铁粉,产生无色气体,该气体遇到空气变为红棕色,溶液中Fe2+的浓度和加入Fe粉的物质的量之间的关系如图所示,则原稀溶液中HNO3和Fe(NO3)3的物质的量浓度之比为( )
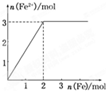
A.4:1
B.3:1
C.2:1
D.1:1难度: 中等查看答案及解析
-
相对分子质量为M的气态化合物V L(标准状况),溶于m g水中,得到质量分数为w%的溶液,物质的量浓度为c mol/L,密度为ρ g•cm-3,则下列说法正确的是( )
A.相对分子质量M=
B.物质的量浓度c=
C.溶液的质量分数w%=
D.溶液密度ρ=难度: 中等查看答案及解析