-
铜、碳、氮、硫、氯等是组成物质的重要元素。
(1)S、Cl组成的一种化合物的分子结构与H2O2相似,则此化合物的结构式为________。N、O、S三种元素的电负性由大到小的顺序为____________。
(2)铜离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。某化合物Y与Cu(Ⅰ)(Ⅰ表示化合价为+1)结合形成图甲所示的离子。
①写出Cu(Ⅰ)的电子排布式:____________;
②该离子中含有化学键的类型有________(填序号);
A.极性键 B.离子键 C.非极性键 D.配位键
③该离子中C原子的杂化方式有________。

(3)向氯化铜溶液中通入足量的二氧化硫,生成白色沉淀M,M的结构如图乙所示。写出该反应的离子方程式:_____________________________________
___________________________________。
难度: 困难查看答案及解析
-
短周期非金属元素A、B、C的核电荷数依次增大,A原子的外围电子排布式为ns2np2,C是地壳中含量最多的元素。元素D、E都位于第四周期,其中E的核电荷数为29,D原子的核外未成对电子数在同周期中是最多的。请用对应的元素符号或化学式填空:
(1)元素A、B、C的第一电离能由小到大的顺序为________。
(2)已知(AB)2分子中键与键之间的夹角为180°,并有对称性,且每个原子的最外层电子数均满足8电子结构,则其结构式为________,1 mol该分子中含有的π键的数目为________。
(3)基态D原子的外围电子排布式为________。化合物DO2Cl2的熔点是-96.5 ℃,沸点是117 ℃,则固态DO2Cl2属于________晶体。
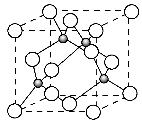
(4)已知元素E的氢化物的晶胞结构如上图所示,则其化学式为___________
难度: 困难查看答案及解析
-
有原子序数依次增大的A、B、C、D、E五种元素,A是短周期中族序数等于周期数的非金属元素;B元素的原子既不易失去,也不易得到电子,其基态原子每种轨道中电子数相同;C元素的价电子构型为nsnnpn+1;D的最外层电子数与电子层数之比为3∶1;E是地壳中含量仅次于铝的金属元素,其合金用途最广,用量最大。
(1)B与D形成的非极性分子中中心原子的孤电子对数是________,中心原子的杂化轨道类型为________。
(2)A分别与B、C、D能形成电子数为10的化合物,它们的沸点由高到低的顺序是________(写分子式),它们的稳定性由弱到强的顺序是________(写分子式)。
(3)分子ABC、BA2D的空间构型分别是________、________。
(4)B、C、D三种元素的电负性由大到小的顺序是________(用元素符号表示),第一电离能由大到小的顺序是________(用元素符号表示)。
(5)一个C的单质分子中存在________个π键、________个σ键。
(6)E的三种同素异形体,晶胞如图所示:
其中晶胞γ的堆积模型中E原子的配位数为________,该晶胞中所含原子数为________。
难度: 困难查看答案及解析
-
Ⅰ.下列化合物中,含有非极性共价键的离子化合物是 ( )。
A.CaC2 B.N2H4 C.Na2S2 D.NH4NO3
Ⅱ.图A所示的转化关系中(具体反应条件略),a、b、c和d分别为四种短周期元素的常见单质,其余均为它们的化合物,i的溶液为常见的酸,a的一种同素异形体的晶胞如图B所示。

回答下列问题:
(1)图B对应的物质名称是________,其晶胞中的原子数为________,晶体类型为________。
(2)d中元素的原子核外电子排布式为________。
(3)图A中由二种元素组成的物质中,沸点最高的是________,原因是________________________________________________________________________,该物质的分子构型为________,中心原子的杂化轨道类型为________。
(4)图A中的双原子分子中,极性最大的分子是________。
(5)k的分子式为________,中心原子的杂化轨道类型为________,属于________分子(填“极性”或“非极性”)。
难度: 极难查看答案及解析
-
我国部分城市灰霾天占全年一半,引起灰霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气的原因主要是交通污染。
(1)Zn2+在基态时核外电子排布式为_______________________________。
(2)SO42—的空间构型是________(用文字描述)。
(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2===CH—CHO、HCOOH、
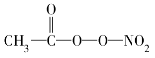 (PAN)等二次污染物。
(PAN)等二次污染物。①下列说法正确的是________;
a.N2O结构式可表示为N===N===O
b.O3分子呈直线形
c.CH2===CH—CHO分子中碳原子均采用sp2杂化
d.相同压强下,HCOOH沸点比CH3OCH3高,说明前者是极性分子,后者是非极性分子
②1 mol PAN中含σ键数目为________;
③NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________(填数字)。
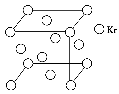
(4)测定大气中PM2.5的浓度方法之一是β射线吸收法,β射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则m/n=________(填数字)。
难度: 极难查看答案及解析
-
2012年12月,我国成功实现歼—15飞机在“辽宁号”航母上的起降实验,建造航母平台和舰载飞机离不开如钛、物质A等材料。请回答下列问题:
(1)写出钛基态原子的核外电子排布式:___________________________。
(2)已知元素A处于第3周期,其原子的第一至第四电离能数据如表所示:
电离能(kJ/mol)
I1
I2
I3
I4
A
738
1 451
7 733
10 540
①A的元素符号为________。
②与元素A同周期的电负性最大的元素为________(填元素符号),该元素能与同周期的另一种非金属元素形成5原子分子,该分子的中心原子采用的杂化方式是________,该分子的空间构型为________。
(3)钛镁合金是制造高性能飞机的重要材料。已知钛、镁金属均采用六方最密堆积(
),下列说法正确的是________(填序号)。
A.用钛镁合金来制造高性能飞机,主要由于其价格昂贵,制造出的飞机能卖个好价钱
B.在高温下切割金属钛不会产生任何安全事故
C.钛、镁金属晶体中,其配位数均为12
D.金属钛的熔点很高(1 668 ℃),与金属键关系不大
(4)钙钛型复合氧化物(如图所示)可用于制造航空母舰中的热敏传感器,该晶体以A原子为晶胞的顶点,A可以是Ca、Sr、Ba或Pb,当B是V、Cr、Mn或Fe时,这种化合物具有很好的电化学性能。用A、B、O表示钙钛型复合氧化物晶体的化学式为________。

难度: 极难查看答案及解析