-
下列说法中,正确的是
A.合金的熔点一般比组成合金的各成分金属高
B.我国规定商家不得无偿提供塑料袋,目的是降低成本
C.红宝石、蓝宝石和金刚石都是由碳元素组成的宝石
D.氮化硅、光导纤维、氧化铝陶瓷等属于新型无机非金属材料
难度: 中等查看答案及解析
-
正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.16O与18O互为同位素;
、
、
、
互为同素异形体
B.SiH4、PH3、HCl的稳定性逐渐增强
C.氧化铁的化学式:FeO
D.Ca2+的结构示意图为
,NH4Cl的电子式为
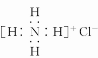
难度: 中等查看答案及解析
-
下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度均降低
B.氯水和双氧水均要盛装在棕色试剂瓶中
C.SO2能使品红溶液和溴水均褪色
D.NaCl固体中混有NH4Cl或I2,均可用加热法除去
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. NaAlO2溶液中通入过量CO2:2AlO2—+CO2+3H2O=2Al(OH)3↓+CO32-
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.氧化铜溶于浓硝酸:CuO+2H+=Cu2++2H2O
D.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列实验操作或说法错误的是
A.蒸发时,蒸发皿中固体不能蒸干才停止加热
B.蒸馏时,温度计水银球应靠近蒸馏烧瓶的支管口处
C.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.焰色反应时,用稀硫酸洗净铂丝,并在火焰上灼烧至无色
难度: 中等查看答案及解析
-
用NA代表阿伏加德罗常数的数值,下列叙述正确的是
A.在铁参与的反应中,5.6g铁完全反应失去的电子数一定为0.3NA
B.1mol 12C18O2中,所含的中子数为22NA
C.标准状况下,11.2 LCO和N2混合气体中含有的分子数是0.5NA
D.常温下,pH=12的1L氨水中含有的NH3·H2O分子数是0.01 NA
难度: 中等查看答案及解析
-
常温下,下列不发生反应的一组物质是
①铜与浓硫酸 ②二氧化硅与NaOH溶液 ③铜与浓硝酸 ④石英与纯碱
⑤铁与液氯 ⑥一氧化氮与氧气 ⑦硅与氧气 ⑧H2S与SO2
A.①②③⑥ B.②③⑥⑧ C.①④⑤⑦ D.①②③⑦
难度: 中等查看答案及解析
-
下列实验合理的是
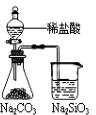

A.证明非金性
Cl>C>Si B.吸收氨气,
并防止倒吸 C.制备并收集少量NO2气体 D.制备CO2
难度: 中等查看答案及解析
-
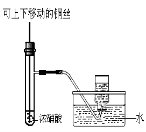
某化学兴趣小组的同学用如图所示装置研究电化学问题。当闭合该装置的电键时,观察到电流计的指针发生偏转。下列有关说法错误的是
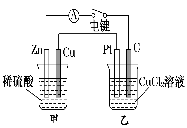
A.甲装置是原电池,乙装置是电解池
B.当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g
C.实验一段时间后,甲烧杯中溶液的pH增大
D.将乙中的C电极换成铜电极,则乙装置可变成电镀装置
难度: 中等查看答案及解析
-
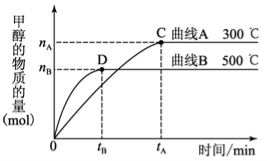
可逆反应aA(g) + bB(g)
cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
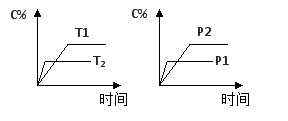
A.达平衡后,若升温,平衡左移
B.达平衡后,加入催化剂则C%增大
C.化学方程式中a+b>c+d
D.达平衡后,减少A的量有利于平衡向右移动
难度: 中等查看答案及解析
-
将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2]的混合溶液中,生成沉淀与通入CO2的量的关系可表示为

A B C D
难度: 中等查看答案及解析
-
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4。下列说法正确的是
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2发生反应,有10 mol电子转移
C.产物中的SO42-有一部分是氧化产物
D.FeS2只作还原剂
难度: 中等查看答案及解析
-
室温下,将0.100 0 mol·L-1盐酸滴入20.00 ml 未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图。下列有关说法不正确的是
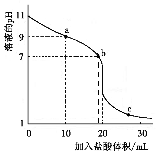
A.该一元碱溶液浓度为0.100 0 mol·L-1
B.a、b、c点的水溶液导电性依次增强
C.室温下,MOH的电离常数Kb=1×10-5
D.b点:c(M+)+c(MOH)=c(Clˉ)
难度: 中等查看答案及解析
-
常温下,物质的量浓度为0.01 mol·L-1的醋酸溶液和盐酸,下列说法正确的是
A.溶液的pH相同
B.分别加入足量锌片,盐酸生成的H2体积大
C.分别稀释100倍后,醋酸浓度与盐酸浓度相等
D.由水电离出的氢离子浓度均为1×10-12 mol·L-1
难度: 中等查看答案及解析
-
1.92 g Cu投入到一定量的浓硝酸中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672 ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为
A.504 ml B.336 ml C.224 ml D.168 ml
难度: 中等查看答案及解析