-
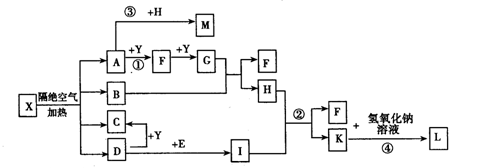
已知X为一种盐,A、C、D、F为无色气体,B常温常压下为无色无味的液体,I和Y为中学化学常见的单质,其中Y为气体,I为紫红色固体,E为黑色固体氧化物,L为蓝色沉淀。其中有些反应的条件及部分生成物被略去。
回答下列问题:
(1)写出C的电子式________,L的化学式________。
(2)写出反应①的化学反应方程式____________;反应①一④中属于氧化还原反应的是________。
(3)写出反应②的离子反应方程式____________。
(4)M的水溶液呈酸性,其原因为(用离子方程式表示)____________。
(5)利用电解可提纯I物质,在该电解反应中电解质溶液是____________;写出阴极的电极反应式____________。
(6)已知1 mol X在隔绝空气条件下分解产生的各产物的物质的量之比为A:B:C:D=2:1:1:1请推测A的化学式为____________。
-
黄铁矿在高温时和氧气反应生成氧化铁和二氧化硫。某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]:测定硫元素的含量
I.将m1g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的硬质玻璃管D中,A中的试剂是双氧水。从A中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的黄铁矿样品至反应完全。

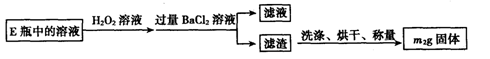
Ⅱ.反应结束后,将E瓶中的溶液进行如下处理:
[实验二]测定铁元素的含量。
Ⅲ,测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解硬质玻璃管D中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL。
请完成下列问题:
(1)仪器B中发生反应的化学方程式是:____;仪器C中装入的试剂是____。E瓶的作用是____。
(2)Ⅱ中所加H2O2溶液需足量的理由是____;写出加入H2O2发生反应的离子方程式____。
(3)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有________;④中量取稀释液25.00mL需用的仪器是____________。
(4)该黄铁矿中硫元素的质量分数为____________(用含m1和m2的代数式表示);该黄铁矿中铁元素的质量分数为____________(用含m1 c、y的代数式表示)
-
甲醇是一种可再生能源,具有广泛的开发和应用前景。

(1)工业上一般采用如下反应合成甲醇:
CO(g)+2H2(g) CH2O H(g)△H= xkJ/mo①右图是反应时CO和CH3 0H的浓度随时间的变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=____________。
②下表所列数据是该反应在不同温度下的化学平衡
常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断x________0(填“<”、“<”填“=”)
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得
c(CO)=0.2mol/L,则CO的转化率为____。
(2)已知在常温常压下
①2CH3OH(1)+3O2(g) 2CO2(g)+4H2O(g) △H=—1275.6kJ/mol
②2CO(g)+O2(g) 2CO2(g)△H=—566.0kJ/mol
③H2O(g) H2O(1) △H=—44.0kJ/mol
请计算1mol甲醇不完全燃烧生成lmolCO和液态水放出的热量为____。
(3)利用甲醇燃料电池设计如右图所示的装置:
则该装置中b为____极;Cu极的电极反应式为____。
当铜片的质量变化为25.6g时,a极上消耗的O2在标准状况下的体积为___________L。

-
已知:A、B、C、D、E、F是周期表中前36号元素,A是原子半径最小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D是元素周期表中电负性最大的元素,E2+的核外电子排布和Ar原子相同,F的核电荷数是D和E的核电荷数之和。
请回答下列问题:
(1)分子式为BC2的空间构型为____________;F2+的核外电子排布式为________。
(2)A分别与B、C形成的最简单化合物的稳定性B____C(填“大于”或“小于”);A、C两元素可组成原子个数比为1:1的化合物,C元素的杂化类型为。
(3)A2C所形成的晶体类型为____________;F单质形成的晶体类型为________,其采用的堆积方式为________。
(4)F元素氧化物的熔点比其硫化物的____(填“高”或 “低”),请解释其原因____。
(5)D跟E可形成离子化合物,其晶胞结构如右图。该离子化合物晶体的密度为pg.cm。3,则晶胞的体积是________。(用含p的代数式表示)。

-
高聚物Z是一种重要的电子薄膜材料,P是一种广泛应用的增塑剂。以下是某研究小组设计的他们的合成路线。

已知以下信息:
①l molF在O2中充分燃烧,消耗7.5 rriol O2,生成8 nl01 C02和3 mol H20,l mol F与足量NaHCO3溶液反应生成2 rriol C02。其核磁共振氢谱中有3个吸收峰。
②已知: (R、R,代表烃基或氢原子)。
(R、R,代表烃基或氢原子)。
③A是一种醛,B→C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氢原子。
④D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有一个—CH3。
请回答以下问题:
(1)X的结构简式是________。F分子中含有的含氧官能团的名称是________。
(2)写出反应①的化学方程式________。反应②的化学方程式是________。
(3)反应③的化学方程式是________。
(4)C的结构简式是_________;P的结构简式是-。
(5)符合下列条件的B的同分异构体共有(填数字)________种。
a.在酸性条件下水解为M和N b.-定条件下M可以转化为N







 (R、R,代表烃基或氢原子)。
(R、R,代表烃基或氢原子)。