-
化学与生活密切相关,下列说法正确的是
A.氟利昂作制冷剂会加剧雾霾天气的形成
B.计算机芯片的材料是二氧化硅
C.汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的
D.“轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适
难度: 简单查看答案及解析
-
设NA表示阿伏加徳罗常数,下列叙述中正确的是
A.1L 1mol·L-1的盐酸溶液中,所含氯化氢分子数为NA
B.11.2L氧气中所含有的原子数为NA
C.常温常压下42g乙烯和丁烯混合气体中,极性键数为6NA
D.1L0.lmol/L 的 Fe2(SO4)3 溶液中,Fe3+的数目为 0.2NA
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.塑料、合成纤维和合成橡胶都属干合成材料
B.甲苯与氯气在光照下反应主要生成2,4-二氯甲苯
C.(CH3)3CCH2CH3的一氯代物有5种
D.合成顺丁橡胶(
 )的单体是CH3-CH=CH-CH3
)的单体是CH3-CH=CH-CH3难度: 中等查看答案及解析
-
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是
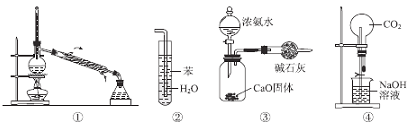
A.装置①常用于分离互不相溶的液体混合物
B.装置②可用于吸收氨气,且能够防止倒吸
C.装置③可用于制备少量NH3
D.装置④无法形成喷泉
难度: 中等查看答案及解析
-
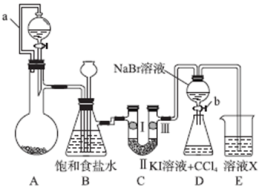
某种三室微生物燃料电池污水净化系统原理如图所示,图中有机废水(酸性)中的有机物可用C6H10O5表示[交换膜分别是只允许阴(阳) 离子通过的阴(阳)离子交换膜],下列有关说法中不正确的是
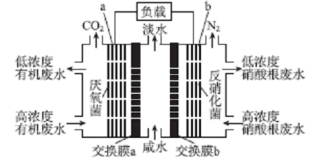
A.电池工作时,电子由a极经导线流向b极
B.交换膜a是阴离子交换膜
C.电极 b 的反应式:2NO3-+l0e-+12H+=N2↑+6H2O
D.相同时间内(相同状况下)生成CO2和N2的体积比为2:5
难度: 困难查看答案及解析
-
下图所示与对应叙述相符的是


A.—定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y
Z
B.图2表示NaOH溶液滴加到0.lmol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂
C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13时,溶液中c(Na+)> c(CH3COO- )>c(OH-)>c(H+)
D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与 Ag+反应生成沉淀),由图4可确定首先沉淀的是C-
难度: 困难查看答案及解析
-
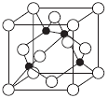
W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:四种元素的电子层数之和为10,且它们分别属于连续的四个主族。四种元素的原子中半径最大的是X原子。下列说法正确的
A. 四种元素中有两种元素在第二周期
B. W所在主族元素的原子次外层电子数可能为2或8,不可能为18
C. X、Y、Z的最高价氧化物对应的水化物两两之间能反应
D. 工业上获得X、Y单质的方法主要是电解其熔融的氯化物
难度: 中等查看答案及解析