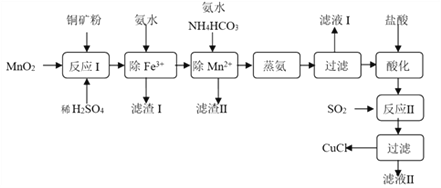
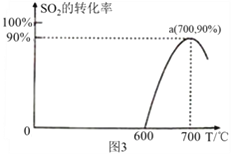
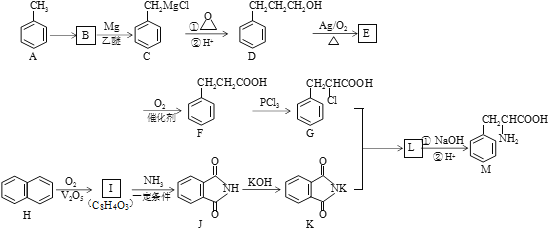
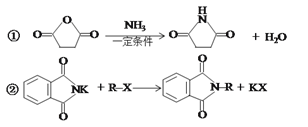
-
化学与社会、生产、生活密切相关,下列说法错误的是
A. 樟脑丸释放的物质能驱除衣柜里的蟑螂
B. 废旧钢材焊接前,可依次用饱和Na2CO3溶液、饱和NH4Cl溶液处理焊点
C. 使用可降解的聚碳酸酯塑料和向燃煤中加入生石灰,都能减少温室效应
D. 《泉州府志》中有:元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之,其原理是泥土具有吸附作用,能将红糖变白糖
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述错误的是
A. 室温下,pH=12的Ba(OH)2溶液中Ba2+的数目为5×10-3NA
B. 14g乙烯和14g丙烯中含有的共用电子对数均是3NA
C. 1 mol FeI2与一定量氯气反应时,若有0.5mol Fe2+被氧化则转移的电子数为2.5NA
D. 0.4mol AgNO3受热完全分解(2AgNO3
2Ag+2NO2↑+O2↑),用排水法最终收集到气体的分子数为0.1NA
难度: 中等查看答案及解析
-
下列实验操作、现象与结论均正确的是
选项
实验操作
实验现象
结论
A
25℃,两片相同的Al片分别和等体积的稀HNO3和浓HNO3反应
前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈
其他条件相同时,反应物浓度越大,反应速率越快
B
往黄色固体难溶物PbI2中加水,振荡,静置。取上层清液,然后加入NaI固体
产生黄色沉淀
难溶物PbI2存在沉淀溶解平衡
C
向蛋白质溶液中分别加入乙醇溶液和(NH4)2SO4饱和溶液
均产生白色沉淀
蛋白质均发生了变性
D
向稀硫酸中加入铜片,然后通入氧气加热
开始无明显现象,通入氧气加热后溶液变蓝
氧化性:稀硫酸 > Cu2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下图为有机物M、N、Q的转化关系,有关说法正确的是
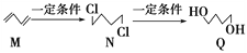
A. M生成N的反应类型是取代反应
B. N的同分异构体有6种
C. 可用酸性KMnO4溶液区分N与Q
D. 0.3 mol Q与足量金属钠反应生成6.72L H2
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z、R 原子序数依次增大。由W、X、Y、R组成的一种化合物a在加热时完全分解为三种产物,其中一种产物b是能使品红溶液褪色的气体,另一种产物c是能使湿润的红色石蕊试纸变蓝的气体。金属单质Z在空气中燃烧生成的化合物可与水发生反应生成气体。下列说法正确的是
A. 简单离子的半径: X < Z < R
B. X的简单氢化物比Y的稳定
C. a、b、c中均含有极性共价健,且 a属于电解质,b和c都属于非电解质
D. W、X、Y、R四种元素形成的化合物一定会促进水的电离
难度: 中等查看答案及解析
-
硼酸(H3BO3)为一元弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH- = B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法正确的是

A. 电子流向: 电源负极→b电极→电解液→a 电极→电源正极
B. 阳极的电极反应式为:2H2O - 4e- = O2↑+4H+
C. 当电路中通过3mol电子时,可得到1mol H3BO3
D. A膜为阳膜,B膜为阴膜,且穿过A膜和B膜的离子数相同
难度: 中等查看答案及解析
-
已知Kb(NH3·H2O)=1.7×10-5,Ka(CH3COOH)=1.7×10-5。25℃时,向20mL浓度均为0.01mol·L-1的盐酸和醋酸的混合溶液中逐滴加入0.01mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法错误的是
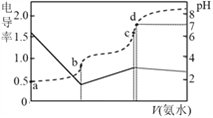
A. a点溶液中,c(CH3COO-)数量级约为10-5
B. b点溶液中,c(NH4+) > c(CH3COOH)
C. c点溶液中,c(NH4+) +c(NH3·H2O) = c(Cl-)+c(CH3COO-)+c(CH3COOH)
D. c点水的电离程度小于d点
难度: 困难查看答案及解析