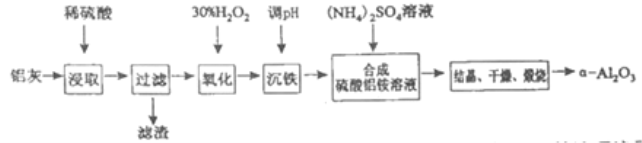
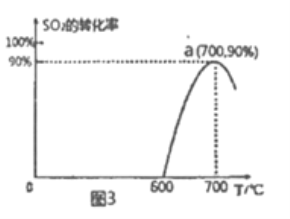
-
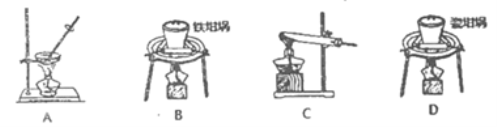
下列实验操作正确的是
A. 开启易挥发液体试剂前,应反复摇动后再开启
B. 在实验室中进行蒸馏操作时,温度计应插入液面之下
C. 实验室制取氢气后的废液,可先倒入水槽中,再用水冲入下水道
D. 用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
难度: 简单查看答案及解析
-
W、X、Y、Z是短周期元素,原子序数依次递增。W与Y位于同一主族,X的单质既能与盐酸反应也能与NaOH溶液反应,Y原子的最外层电子数是次外层电子数的一半,X、Y、Z原子的最外层电子数之和为14。下列说法不正确的是
A. 原子半径:X>Y
B. X与Z形成的化合物的水溶液pH<7
C. 最简单气态氢化物的稳定性: W<Y<Z
D. 最高价氧化物对应水化物酸性的强弱: Z>W>Y
难度: 中等查看答案及解析
-
化合物W、X、Y、Z的分子式均为C7H8,Z的空间结构类似于篮子。 下列说法正确的是
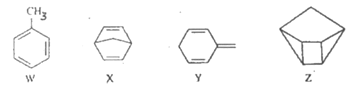
A. Z的一氯代物只有3种
B. 化合物W的同分异构体只有X、Y、Z
C. X、Y、Z均可与酸性KMnO4溶液反应
D. 1molX、1molY与足量Br2/CCl4溶液反应最多消耗Br2均为2mol
难度: 中等查看答案及解析
-
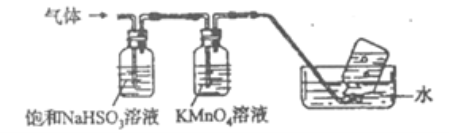
利用下图装置可以进行实验并能达到实验目的的是
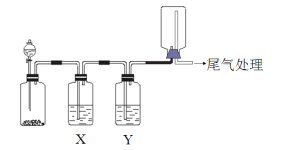
选项
实验目的
X中试剂
Y中试剂
A
用MnO2和浓盐酸制取并收集纯净干燥的Cl2
饱和食盐水
浓硫酸
B
用Cu与稀硝酸制取并收集纯净干燥的NO
水
浓硫酸
C
用CaCO3和稀盐酸制取并收集纯净干燥的CO2
饱和NaHCO3溶液
浓硫酸
D
验证电石与饱和食盐水反应生成的气体的性质并收集
CuSO4溶液
KMnO4 溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
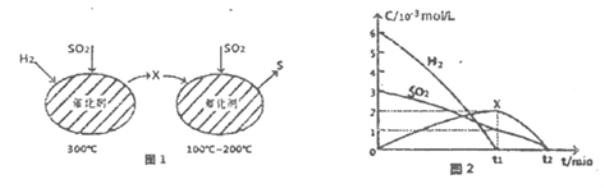
微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是
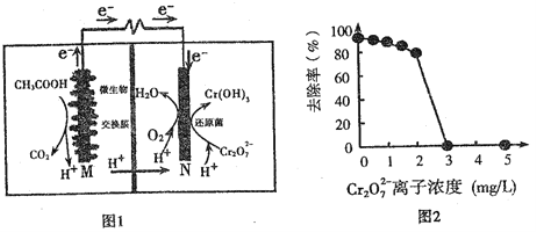
A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
难度: 困难查看答案及解析
-
若用AG表示溶液的酸度,其表达式为: AG=lgc(H+)/c(OH-)。室温下,实验室里用0.1 mol/L的盐酸溶液滴定10mL0.1 mol/L MOH溶液,滴定曲线如下图所示。下列说法正确的是
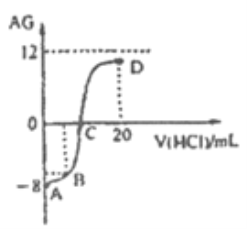
A. 该流定过程可选择酚酞作为指示剂
B. 溶液中由水电离的c(H+): C点>D点
C. C点时加入盐酸溶液的体积等于10 mL
D. 若B点加入的盐酸溶液体积为5 mL,所得榕液中: c(M+) +c(H+)= c(MOH)+ c(OH-)
难度: 中等查看答案及解析

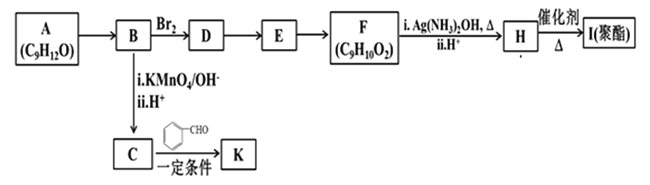
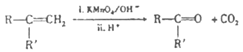

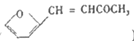 )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇(CH3)3COH]和糠醛(