-
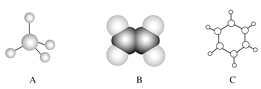
在下列反应中,反应物的总能量低于生成物的总能量的是
A. 2H2+O2
2H2O B. CaCO3
CaO+CO2↑
C. CaO+CO2=CaCO3 D. C2H5OH+3O2
2CO2+3H2O
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A. MgO、Al2O3熔点高,均可用作耐高温材料
B. NH4HCO3受热易分解,可用作氮肥
C. Fe2(SO4)3易溶于水,可用作净水剂
D. SO2具有氧化性,可用于漂白纸浆
难度: 简单查看答案及解析
-
下列事实与平衡移动原理无关的是
A. 向含酚酞的Na2CO3溶液中滴加BaCl2溶液,红色变浅
B. 加热MgCl2·6H2O固体最终得到Mg(OH)Cl
C. 将FeS2矿石粉碎更有利于焙烧制备SO2气体
D. NO2气体经过冷凝和加压成无色液体
难度: 中等查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g),在不同的情况下测得反应速率,其中反应速率最快的是
A. v(D)=0.4 mol·(L·s)-1 B. v(C)=0.5mol·(L·s)-1
C. v(B)=0.6mol·(L·s)-1 D. v(A)=0.15mol·(L·s)-1
难度: 简单查看答案及解析
-
在Na2CO3溶液中,下列说法错误的是
A. 溶液呈碱性
B. 若升高温度,溶液中c(OH─)增大
C. 若加入少量NaOH固体,溶液中c(CO32─)增大
D. 溶液中的离子浓度存在关系:c(Na+)+c(H+)=c(OH─)+c(HCO3─)+c(CO32─)
难度: 中等查看答案及解析
-
常温下,将0.1 mol·L-1盐酸溶液与0.06 mol·L-1氢氧化钡溶液等体积混合,该混合溶液的pH等于( )
A. 1.7 B. 2.0 C. 12.0 D. 12.4
难度: 简单查看答案及解析
-
两种气态烃的混合气体共1 mol,在空气中燃烧得到1.5 mol CO2和2 mol H2O,关于该混合气体的说法正确的是
A. 一定含有甲烷,不含乙烷
B. 一定含乙烷,不含甲烷
C. 一定是甲烷和乙烯的混合气体
D. 一定含甲烷,但不含乙烯
难度: 简单查看答案及解析
-
最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”﹣全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
A. 分子中三个碳原子可能处于同一直线上
B. 全氟丙烷的电子式为:
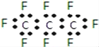
C. 相同压强下,沸点:C3F8<C3H8
D. 全氟丙烷分子是既有极性键又有非极性键的极性分子
难度: 中等查看答案及解析
-
己烯雌酚(结构简式如图所示》,是一种激素类药物。下列叙述正确的是

A. 己烯雌酚分子式为C18H12O2
B. 己烯雌酚与NaOH溶液、NaHCO3溶液均能反应
C. 1mol己烯雌酚最多能与4mol溴发生反应
D. 己烯雌酚可以发生加成反应,取代反应、氧化反应
难度: 中等查看答案及解析
-
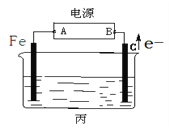
如图所示实验装置,下列说法不正确的是

A. 装置为铁的吸氧腐蚀实验
B. 一段时间后,向插入石墨棒的玻璃筒内滴入石蕊试液,可观察到石墨附近的溶液变红
C. 一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀出现
D. 若将装置中饱和食盐水换成稀硫酸,装置为析氢腐蚀
难度: 中等查看答案及解析
-
用含少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了x g,则( )
A. 电解液质量增加x g B. 阴极质量增加x g
C. 阴极质量增加a g,a>x D. 阴极质量增加b g,b<x
难度: 困难查看答案及解析
-
在某恒容的密闭容器中,可逆反应A(g)+B(g)
xC(g)有如图所示的关系曲线,下列说法正确的是

A. 温度:T1>T2 B. 压强:p1>p2
C. 正反应是放热反应 D. x的值是2
难度: 中等查看答案及解析
-
常温下,下列离子浓度关系正确的是( )
A. pH=4的CH3COOH溶液中,c(H+)= c(CH3COO-)=4.0mol·L-1
B. pH=5的CH3COOH和CH3COONa混合溶液中,c(CH3COO-)>c(Na+)
C. 0.1 mol·L-1CH3COONa溶液中,c(Na +)>c(OH-)>c(CH3COO-)>c(H+)
D. 0.1 mol·L-1CH3COONa溶液中,c(Na +)= c(CH3COO-)+ c(OH-)
难度: 困难查看答案及解析
-
甲醇燃料电池是目前开发最成功的燃料电池之一,由甲醇、空气、KOH溶液构成.则下列说法正确的是
A. 电池放电时通入空气的电极为负极
B. 电池的总反应式为2CH3OH+3O2═2CO2+4H2O
C. 电池放电时,电解质溶液中K+ 向正极移动
D. 电池放电时每消耗1 mol CH3OH,正极上反应的物质失去6 mol电子
难度: 中等查看答案及解析
-
H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系正确的是

A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
B. c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-)
C. c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+ c(HC2O4-)
D. pH=7的溶液中:c(Na+)=2c(C2O42-)
难度: 困难查看答案及解析