-
下列仪器中不能用于加热的是
A.烧杯 B.容量瓶 C.试管 D.蒸发皿
难度: 简单查看答案及解析
-
下列实验方案的设计中,不可行的是
A.用溶解、过滤的方法分离KNO3和NaCl固体的混合物
B.用萃取的方法分离水和四氯化碳
C.加稀盐酸后过滤,除去混在铜粉中的少量铁粉和铝粉
D.将氧气和氮气的混合气体通过灼热的铜网,以除去其中的氧气
难度: 中等查看答案及解析
-
下列各组物质中,所含分子数一定相同的是
A.10gH2和10gO2 B.5.6LN2和5.6L CO2
C.14g CO和0.5molBr2 D.标准状况下2.24LH2O和0.1molN2
难度: 中等查看答案及解析
-
维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转化为易吸收的Fe2+,这说明维生素C具有
A.氧化性 B.还原性
C.既有氧化性又有还原性 D.以上均不是
难度: 中等查看答案及解析
-
下列化学方程式中,不能用离子方程式H++OH-=H2O表示的是
A.2NaOH + H2SO4 = Na2SO4+2H2O
B.Ba(OH)2 +2HCl = BaCl2+2H2O
C.Cu(OH)2 + 2HNO3 =Cu(NO3)2 +2H2O
D.KOH+ HCl = KCl+H2O
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.浓盐酸滴在铜片上:Cu+2H+=Cu2++H2↑
B.稀硫酸与氢氧化钡溶液混合:H++SO42-+OH-+Ba2+=BaSO4↓+H2O
C.向氢氧化钠溶液中通人足量CO2:CO2+OH-=HCO3-
D.碳酸钙与硝酸混合:CO32-+2H+= CO2↑+H2O
难度: 中等查看答案及解析
-
下列各组离子可以在溶液中大量共存的是
A.Na+、Ba2+、NO3-、SO42- B.H+、K+、Cl-、OH-
C.K+、H+、NO3-、HCO3- D.K+、Cu2+、Cl-、SO42-
难度: 中等查看答案及解析
-
下列气体中,既可用浓硫酸干燥,又可用固体NaOH干燥的是
A.Cl2 B.O2 C.SO2 D.NH3
难度: 中等查看答案及解析
-
天气预报是百姓生活、工作中备受关注的一件事。近年来我国重点城市已发布“空气质量日报”。 下列物质中不列入首要污染物的是
A.二氧化硫 B.二氧化氮 C.二氧化碳 D.可吸入颗粒物
难度: 简单查看答案及解析
-
下列物质中,不能做漂白剂的是
A.SO2 B.Ca(ClO)2 C.NaClO D.H2SO4
难度: 简单查看答案及解析
-
把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的物质的量之比为1:2.则已反应的Fe3+和未反应的Fe3+的物质的量之比为
A.1:1 B.1:2 C.1:3 D.2:3
难度: 中等查看答案及解析
-
下列能达到实验目的的是

难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法错误的是
A.常温常压下,32gO2和O3的混合气体所含原子数为2NA
B.将7.1g氯气通入足量水中发生反应,所转移的电子数为0.1NA
C.标准状况下,11.2LSO2中含有的分子数为0.5NA
D.23g钠与足量氧气充分反应,转移的电子数一定是NA
难度: 简单查看答案及解析
-
足量的两份铝粉分别与等体积的NaOH溶液和稀硫酸反应,同温同压下产生等体积的气体,则NaOH溶液和稀硫酸的物质的量浓度之比为
A.3:2 B.2:3 C.1:3 D.1:1
难度: 中等查看答案及解析
-
下列对有关实验事实的解释正确的是
A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+
B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理相同
C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,不能说明原溶液一定含有SO42-
D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应
难度: 中等查看答案及解析
-
相同物质的量的Na2O2和Na2O的比较中,不正确的是
A.
两种物质所含原子个数之比为4∶3
B.两种物质所含离子个数之比为4∶3
C.两种物质与足量的CO2反应,消耗气体的质量比为1∶1
D.两种物质与等质量且足量的水反应得到溶液的质量分数之比为1∶1
难度: 中等查看答案及解析
-
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准).则下列有关说法正确的是

A.蓝色石蕊试纸先变红后褪色
B.NaOH溶液可用于除去实验中多余的SO2
C.湿润淀粉KI试纸未变蓝说明SO2的还原性弱于I2
D.品红试纸、沾有KMnO4溶液滤纸均褪色都能证明SO2的漂白性
难度: 中等查看答案及解析
-
Cl2在70℃的NaOH水溶液中,能同时发生两个自身氧化还原反应,完全反应后,测得溶液中NaClO与NaClO3的物质的量之比为4:1,则溶液中NaCl与NaClO的物质的量之比为
A.1:1 B.5:1 C.9:4 D.11: 2
难度: 中等查看答案及解析
-
有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl-)为1.3mol/L,欲将Mg2+、Al3+恰好转化为沉淀,需加入4mol/LNaOH溶液
A.65mL B.40mL C.72mL D.128mL
难度: 中等查看答案及解析
-
将2.56g Cu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况,不考虑2NO2
N2O4),则反应中消耗HNO3的物质的量为
A.0.05 mol B.1 mol C.1.05 mol D.0.13 mol
难度: 中等查看答案及解析

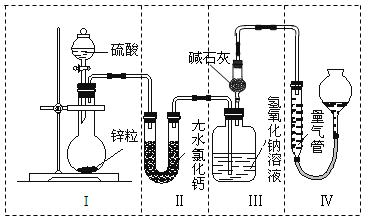
 5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.
5N2+6H2O化学研究性学习小组的同学在技术人员的指导下,按下列流程,探究不同催化剂对NH3还原NO反应的催化性能.