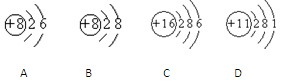-
下列不能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定②HClO氧化性比H2SO4强③HClO4酸性比H2SO4强④Cl2能与H2S反应生成S⑤Cl原子最外层有7个电子,S原子最外层有6个电子⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS⑦HCl酸性比H2S强.
A. ②⑤⑦ B. ①②⑦ C. ②④ D. ①③⑤
难度: 困难查看答案及解析
-
某元素最高价氧化物对应的水化物的化学式为H2XO3,该元素的气态氢化物的化学式是( )
A. XH4 B. H2X C. XH3 D. HX
难度: 简单查看答案及解析
-
根据原子结构及元素周期律的知识,下列推断正确的是
A. H、D、T三种氢的核素在周期表中的位置不同
B. 元素简单气态氢化物越稳定,则非金属性越强
C. 核外电子层结构相同的离子,核电荷数越大其离子半径也越大
D. ⅠA与ⅦA元素形成的化合物都是离子化合物
难度: 简单查看答案及解析
-
下列有关元素周期表中元素性质的叙述不正确的是( )
A. 同主族元素从上到下,非金属性逐渐减弱
B. 元素的最高正化合价在数值上均等于原子的最外层电子数
C. 同周期元素的原子半径从左到右逐渐减小(稀有气体除外)
D. 元素的非金属性越强,它的最高价氧化物的水化物的酸性越强
难度: 中等查看答案及解析
-
砷为第4周期第ⅤA族元素,根据它在元素周期表中的位置推测,砷不可能具有的性质是( )
A. 砷在通常情况下是固体 B. 可以存在-3、+3、+5等多种化合价
C. 砷的原子半径比磷原子大 D. As的最高价氧化物对应水化物的酸性比H3PO4强
难度: 困难查看答案及解析
-
已知原子序数,可以推断原子的 ①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数 ⑥原子结构示意图 ⑦元素在周期表中的位置( )
A. ①②③④⑥ B. ①④⑤⑥⑦ C. ②③④⑤⑦ D. ③④⑤⑥⑦
难度: 中等查看答案及解析
-
现有三种粒子的结构示意图

(其中●表示质子,○表示中子)。则下列有关这三种粒子的叙述正确的是( )
A. 属于不同的元素 B. 具有相同的质量数
C. 具有不同的核电荷数 D. 化学性质相似
难度: 简单查看答案及解析
-
日本福岛第一核电站发生严重的核辐射泄漏,日本政府向核电站附近居民发放碘片(127I),以降低放射性碘对人体的伤害。已知放射性碘(131I)的核电荷数为 53,则下列说法正确的是( )
A. 127I与131I互为同素异形体 B. 131I和131Xe互为同位素
C. 131I 原子的中子数为78 D. 127I 原子和131I 原子的相对原子质量相同
难度: 简单查看答案及解析
-
下列各组物质的性质比较中,正确的是( )
A. 氢化物的沸点:HI>HBr>HCl>HF B. 稳定性:HF>HCl>HBr>HI
C. 离子的还原性:Cl—>Br—>I— D. 单质的熔点:Li<Na<K<Rb
难度: 中等查看答案及解析
-
下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:W > R
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 中等查看答案及解析
-
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是
A. 热稳定性:H2Y<HZ B. 原子半径:W>X>Z>Y
C. 离子半径:W2+>Y2- D. 碱性:XOH<W(OH)2
难度: 简单查看答案及解析
-
在下列变化过程中,被破坏的作用力正确的是()
A. 干冰升华——共价键 B. 氯化钠固体溶解——范德华力
C. 氢氧化钠熔融——离子键、共价键 D. 硫酸氢钠溶于水——离子键、共价键
难度: 中等查看答案及解析
-
W、X、Y、Z是4种短周期元素,在元素周期表中的位置如下图所示,其中Z位于ⅦA族。下列判断错误的是( )
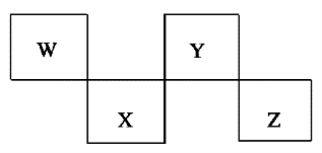
A. 常压下四种元素的单质中,W单质的熔点最高 B. Z的阴离子电子层结构与氩原子的相同
C. W的氢化物的沸点比Y的氢化物的沸点高 D. Y元素的非金属性比X元素的非金属性强
难度: 中等查看答案及解析
-
以下各化合物中,阴离子半径与阳离子半径之比最大的是( )
A. LiBr B. KF C. KBr D. NaCl
难度: 中等查看答案及解析
-
阴离子
含N个中子,X的质量数为A,则ag X的氢化物含质子的物质的量是( )
A.
mol B.
mol
C.
mol D.
mol
难度: 困难查看答案及解析
-
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )

A. 简单离子半径大小关系为B3+>A2+
B. 气态氢化物的稳定性HD<H2C
C. 形成的简单离子的还原性E->D-
D. 最高价氧化物对应的水化物的酸性H2CO4>HEO4
难度: 困难查看答案及解析