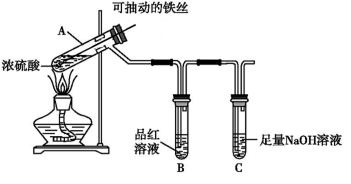
-
化学与生活、社会密切相关。下列说法正确的是
A.正常雨水的pH值为7.0,酸雨的pH值小于7.0
B.亚硝酸盐常做食品防腐剂,可以大量添加于食物中
C.自然界中的固氮作用对植物的生长有害无益
D.大量燃烧化石燃料是造成雾霾天气的重要原因之一
难度: 简单查看答案及解析
-
下列气体不能用浓硫酸干燥的是
A. H2 B.SO2 C.NH3 D. Cl2
难度: 简单查看答案及解析
-
下列物质的主要成分和光导纤维的成分不同的是
A.水晶 B.玛瑙 C.石英 D.计算机芯片
难度: 简单查看答案及解析
-
下列实验现象与氧化还原反应有关的是
A.NH3使湿润的红色石蕊试纸变蓝
B.向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成
C.将氯水长期放置,黄绿色消失
D.向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀
难度: 中等查看答案及解析
-
下列试剂保存正确的是
A.氯水保存在棕色细口瓶中 B.NaOH保存在具有玻璃塞的细口瓶中
C.金属钠保存在CCl4中 D.氢氟酸保存在玻璃塞的细口瓶中
难度: 简单查看答案及解析
-
为了使Al2(SO4)3中的Al3+完全沉淀,适宜用到的试剂是
A.NaOH溶液 B.Ba(OH)2溶液 C.氨水 D.BaCl2溶液
难度: 中等查看答案及解析
-
下列叙述不正确的是
A.碳酸钠可以用于治疗胃酸过多
B.过氧化钠可做航天员的供氧剂
C.金属钠有强还原性,能和硫酸铜溶液反应,但不能析出金属铜
D.为使面包松软可口可用碳酸氢钠做发泡剂
难度: 中等查看答案及解析
-
下列关于容量瓶的使用方法中,正确的是
A.使用前检查是否漏水 B.溶液未冷却即注入容量瓶中
C.容量瓶可长期存放溶液 D.在容量瓶中直接溶解固体
难度: 中等查看答案及解析
-
在无色透明强酸性溶液中,能大量共存的离子组是
A.K+、MnO4-、Mg2+、SO42- B.K+、Na+、Cl-、CO32-
C.Zn2+、Al3+、NO3-、Cl- D.Na+、Fe2+、NO3-、SO42-
难度: 中等查看答案及解析
-
完成下列实验所选择的装置或仪器不正确的是
A
B
C
D
实验
分离水和酒精
用铵盐和碱制取NH3
用排空气法收集NO2
用自来水制取蒸馏水
装置
或
仪器
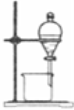
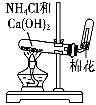
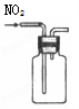
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.铜和稀硝酸的反应:Cu2++4H++2NO3-=Cu2++2NO2↑+2H2O
B.氯化铁腐蚀印刷电路板:Fe3++Cu = Fe2++Cu2+
C.氯化铝溶液加入氨水:Al3++3OH- = Al(OH)3↓
D.实验室制氯气:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.71g氯气中氯原子数为 NA
B.标准状况下,22.4 LNH3所含的电子数为10NA
C.5.6g Fe在足量氯气中燃烧转移的电子数为2NA
D.标准状况下,11.2 L H2O中含有分子的数目为0.5NA
难度: 中等查看答案及解析
-
只用一种试剂就可将AgNO3、KSCN和H2SO4、NaOH四种无色溶液区分,这种试剂
是
A.Fe(NO3)3溶液 B.FeCl2溶液 C.BaCl2溶液 D.FeCl3溶液
难度: 中等查看答案及解析
-
关于SO2的说法有:
①SO2是一种大气污染物;
②SO2和Cl2都有漂白作用,且这两种物质的漂白原理相同;
③工业上可用潮湿的石灰石粉末吸收SO2;
④SO2溶于水得硫酸,SO2是一种酸性氧化物;
⑤SO2是硫及某些含硫化合物在空气中燃烧的产物;
⑥SO2可以使酸性高锰酸钾溶液褪色,因为SO2具有漂白作用。其中正确的是
A.①②⑤ B.①③④⑤ C.①③⑤ D.①③⑤⑥
难度: 中等查看答案及解析
-
下列说法正确的是
A.某溶液中滴加硝酸酸化的Ba(NO3)2溶液有白色沉淀,该溶液一定有SO42-
B.某溶液中滴加盐酸,产生无色无味的气体,将该气体通入澄清的石灰水中产生白色沉淀,则该溶液一定有CO32-
C.某溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则该溶液中一定有NH4+
D.某溶液中滴加AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,则该溶液中一定有Cl-
难度: 困难查看答案及解析
-
下列实验装置不能达到实验目的的是

难度: 困难查看答案及解析
-
某无色混合气体中可能含有Cl2、O2、HCl、SO2、NO2、NO、NH3中的两种或多种。将此无色混合气体通过品红溶液后,品红溶液褪色;把剩余气体排入空气中,气体很快变为红棕色,该无色混合气体遇浓盐酸未看到明显现象。下列关于原混合气体成分的判断正确的是
A.一定有SO2、NH3和NO B.一定有NO和HCl
C.可能有Cl2和O2 D.一定没有Cl2、NO2、NH3和O2
难度: 困难查看答案及解析
-
用以下三种途径来制取等质量的硝酸铜:①铜与稀硝酸反应;②铜与浓硝酸反应;③铜先与氧气反应生成氧化铜,氧化铜再跟稀硝酸反应。以下叙述不正确的是
A.三种途径所消耗的铜的质量相等
B.所消耗的硝酸的物质的量是①>②>③
C.途径③的制备方法是最符合“绿色化学”理念的
D.途径①中被氧化的铜与被还原的硝酸的物质的量比是3:2
难度: 困难查看答案及解析
-
将一定质量的镁和铝混合物投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如下图所示。则下列说法不正确的是
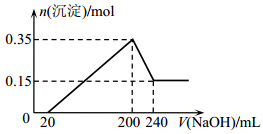
A.生成的氢气在标准状况下的体积为11.2 L
B.最初20 mLNaOH溶液用于中和过量的硫酸
C.硫酸的物质的量浓度为2.5 mol/L
D.镁和铝的总质量为9 g
难度: 极难查看答案及解析