-
对下列化学用语的理解正确的是
A.原子结构示意图
:可以表示12C,也可以表示14C
B.比例模型
:可以表示二氧化碳分子,也可以表示水分子
C.电子式:
可以表示羟基,也可以表示氢氧根离子
D.分子式C2H4O2:可以表示乙酸,也可以表示乙二醇
难度: 中等查看答案及解析
-
用NA表示阿伏德罗常数,下列叙述正确的是
A.标准状况下,22.4LH2O含有的分子数为 NA
B.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C.通常状况下,NA个CO2分子占有的体积为22.4L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为 NA
难度: 中等查看答案及解析
-
将15g两种金属的混合物投入足量的盐酸中,反应完全后得到H2 11.2L(标准状况)该混合物的组成可能是
A.钠和铁 B.镁和铜 C.铝和镁 D.锌和铁
难度: 中等查看答案及解析
-
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各1.5mol,Mg2+为0.5mol,则SO42-的物质的量是
A.0.25 mol B.0.5mol C.0.75mol D.0.75mol
难度: 中等查看答案及解析
-
下列各组离子在对应溶液中可能大量存在的是
A.水电离出的c(H+)=10-12mol·L-1的溶液:K+、Cu2+、SO32-、MnO4-
B.与铝粉反应能放出氢气的溶液:Na+、SO42-、HCO3-、Cl-
C.含有大量ClO-的溶液:H+、I-、SO42-、Cl-
D.pH=12的溶液:K+、Cl-、SO32-、SiO32-
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+=4Fe3++2H2O
B.过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-===CaCO3↓+CO32-+2H2O
C.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑
D.向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
难度: 中等查看答案及解析
-
某溶液中含有AlO2-、SO32-、SO42-、Na+,向其中加入Na2O2后,溶液中浓度基本保持不变的离子是
A.SO32- B.Na+ C.AlO2- D.SO42-
难度: 中等查看答案及解析
-
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+)∶n(Cl-)可能为7∶3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
难度: 困难查看答案及解析
-
下列推断合理的是
A.在常温下,Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,说明H2CO3酸性强于H2SiO3;在高温下,Na2CO3+SiO2= Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3;
B.胶体区别于其他分散系的本质特点是能产生丁达尔现象
C.KAl(SO4)2·12H2O是复盐;(NH4)2Fe(SO4)2也是复盐
D.CaCl2、NaOH、HCl、HD四种物质都属于化合物
难度: 中等查看答案及解析
-
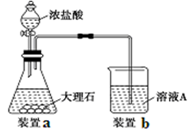
实验室制Cl2的反应为4HCl(浓)+MnO2
MnCl2+C12↑+2H2O.下列说法错误的是
A.还原剂是HCl,氧化剂是MnO2
B.每生成1 molCl2,转移电子的物质的量为2 mol
C.每消耗1 molMnO2,起还原剂作用的HCl消耗4mol
D.生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质
难度: 中等查看答案及解析
-
下表中叙述Ⅰ和叙述Ⅱ均正确并且互为因果关系的是
选项
叙述Ⅰ
叙述Ⅱ
A
NH4Cl是强酸弱碱盐
将NH4Cl溶液蒸干可制备NH4Cl固体
B
Fe3+有强氧化性
用KSCN溶液可以鉴别Fe3+
C
SO2有还原性
用SO2可使溴水褪色
D
Cl2有漂白性
用Cl2可与石灰乳反应制备含氯消毒剂
难度: 中等查看答案及解析
-
下列推断正确的是
A.SiO2是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,与CO2反应产物也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
难度: 中等查看答案及解析
-
(3分)下列有关实验的叙述中,正确的是
A.容量瓶用蒸馏水洗净后,可不经干燥直接用于配制溶液
B.用分液的方法分离水和酒精的混合物
C.配制1L0.1mol/L的NaCl溶液时可用托盘天平称量5.85gNaCl固体
D.用滴管滴加液体时,为防止液滴飞溅,滴管紧贴试管内壁
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.Cl2通入FeSO4溶液中
B.CO2通入Ca(OH)2溶液中
C.将AlCl3溶液滴入 NaOH 溶液中
D.SO2通入BaCl2溶液中
难度: 中等查看答案及解析
-
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液,其中NaNO2的物质的量为
A.0.2mol B.0.6mol
C.0.8mol D.1.0mol
难度: 中等查看答案及解析
-
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120 mL (标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2∶1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4 的混合气体中,NO2 的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
难度: 困难查看答案及解析