-
向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加水稀释时,都会引起( )
A.溶液的pH增大
B.CH3COOH的电离程度增大
C.溶液的导电能力减小
D.溶液的c(OH-)减小难度: 中等查看答案及解析
-
若溶液中由水电离产生的c(OH-)=1×10-14mol•L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl-
B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2-
D.K+、NH4+、SO42-、NO3-难度: 中等查看答案及解析
-
在一定条件下,反应2HI(g)⇌H2(g)+I2(g)△H>0,达到平衡时,要使混合气体的颜色加深,可采取的措施是:( )
①增大氢气的浓度 ②升高温度 ③降低温度 ④缩小体积 ⑤增大HI的浓度 ⑥减小压强.
A.①③⑥
B.③⑤⑥
C.①③⑤
D.②④⑤难度: 中等查看答案及解析
-
下列各组物质中,都是强电解质的是( )
A.HBr、HCl、BaSO4
B.NH4Cl、CH3COONa、H2S
C.NaOH、Ca(OH)2、NH3•H2O
D.HClO、NaF、Ba(OH)2难度: 中等查看答案及解析
-
25℃时,向V mL pH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是( )
A.15
B.14
C.13
D.不能确定难度: 中等查看答案及解析
-
在一定条件下,发生CO+NO2⇌CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是( )
A.正反应为吸热反应
B.正反应为放热反应
C.降温后CO的浓度增大
D.降温后各物质的浓度不变难度: 中等查看答案及解析
-
pH值相同的醋酸和盐酸,分别用蒸馏水稀释到原来体积的m倍和n倍,稀释后两溶液的pH值仍相同,则m和n的关系是( )
A.m>n
B.m=n
C.m<n
D.不能确定难度: 中等查看答案及解析
-
下列说法正确的是( )
A.水解反应是吸热反应
B.升高温度可以抑制盐类的水解
C.正盐水溶液pH均为7
D.硫酸钠水溶液pH小于7难度: 中等查看答案及解析
-
室温时,下列混合溶液的pH一定小于7的是( )
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合难度: 中等查看答案及解析
-
下列说法正确的是( )
A.自发反应都是放热反应
B.自发反应在任何条件下都能实现
C.自发反应都是熵增大的反应
D.铁在潮湿空气中生锈是自发过程难度: 中等查看答案及解析
-
某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
A.0.04
B.0.04mol/
C.0.08mol/
D.0.04mol/L难度: 中等查看答案及解析
-
25℃的下列溶液中,碱性最强的是( )
A.1L中含有4gNaOH的溶液
B.c(OH-)=0.2mol/L的溶液
C.pH=11的溶液
D.c(H+)=1×10-10mol/L的溶液难度: 中等查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.
B.
C.c(H+)和c(OH-)的乘积
D.OH-的物质的量难度: 中等查看答案及解析
-
将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,不影响水的电离平衡的是( )
A.①③⑤⑦⑧
B.②④⑦
C.①⑥
D.②④⑥⑧难度: 中等查看答案及解析
-
根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol分析下列说法中正确的是( )
A.S(g)+O2(g)=SO2(g)|△H|>297.23kJ/mol
B.S(g)+O2(g)=SO2(g)|△H|<297.23kJ/mol
C.1molSO2(g)所具有的能量大于1molS(s)与1molO2(g)所具有的能量之和
D.1molSO2(g)所具有的能量小于1molO2(g)所具有的能量难度: 中等查看答案及解析
-
在一个固定容积的密闭容器中发生如下反应:2A(g)+B(g)⇌3C(g)+D(g),当加入4mol A和2mol B,达化学平衡时,C的物质的量浓度为m mol•L-1.若维持温度不变,按下列四种配比为起始物质,达到化学平衡后,C仍为m mol•L-1的是( )
A.2molA+1molB
B.6molC+2molD
C.3molC+1molD
D.4molA+2molB+3molC难度: 中等查看答案及解析
-
在密闭容器,一定条件下进行反应,mA(s)+nB(g) pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过程均如图所示,则对该反应叙述正确的是( )
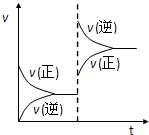
A.逆反应是吸热反应
B.正反应是吸热反应
C.m+n>p+q
D.m+n<p+q难度: 中等查看答案及解析
-
在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+O2(g)═CO2(g)+2H2O(l)△H=+725.8kJ/mol
B.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ/mol
C.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-725.8kJ/mol
D.2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=+1452kJ/mol难度: 中等查看答案及解析
-
在温度相同,压强分别为P1和P2的条件下,A(g)+2B(g)⇌n C(g)的反应体系中,C的百分含量(c%)与时间t的曲线如图所示,下面结论正确的是( )
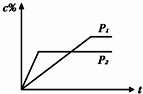
A.P1>P2,n<3
B.P1<P2,n>3
C.P1>P2,n>3
D.P1<P2,n<3难度: 中等查看答案及解析
-
把6molA和5molB两气体通入容积为4L的密闭容器中,一定条件下反应:3A(g)+B(g)
2C(g)+xD(g);△H<0,5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol•-1.下列说法中正确的是( )
A.A的平均反应速率为0.15mol•-1
B.恒温下达到平衡的标志是C和D的生成速率相等
C.降低温度,逆反应速率变小,正反应速率增大,平衡正向移动
D.B的转化率为25%难度: 中等查看答案及解析
-
某温度下,在一容积可变的容器里,反应2A(g)
B(g)+2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol、4mol.在保持温度和压强不变的条件下,下列说法正确的是( )
A.充入1mol稀有气体氦(He),平衡将不移动
B.充入A、B、C各1mol,平衡将向正反应方向移动
C.将A、B、C各物质的量都减半,C的百分含量不变
D.加入一定量的A气体达平衡后,C的百分含量一定增加难度: 中等查看答案及解析
-
生活中充满化学,下列有关生活中的化学常识说法不正确的是( )
A.长期用铁强化酱油作佐料,可预防缺铁性贫血
B.食用的碘盐是纯的碘酸钾
C.花草汁沾在白色衣物上可用漂白粉溶液洗去
D.苹果久置变甜主要是因为发生了水解反应难度: 中等查看答案及解析