-
下列物质中,不能与氢氧化钠溶液发生反应的是
A.Mg B.Al(OH)3 C.Al D.CO2
难度: 简单查看答案及解析
-
下列变化属于氧化反应的是
A.CO2→ CO B.Cl- → Cl2
C.Fe3+ → Fe2+ D.CO32- → CO2
难度: 简单查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是
A、硫氰化钾溶液: Na+、Cl-、SO42-、Fe3+
B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C、氢氧化钠溶液:K+、Ba2+、Cl-、Br-
D、碳酸钠溶液:K+、SO42-、Cl-、H+
难度: 中等查看答案及解析
-
在常温下,发生下列几种反应:①16H++10Z-+2XO4-==2X2++5Z2+8H2O ②2A2++B2==2A3++2B- ③2B-+Z2==B2+2Z-根据上述反应,判断下列结论错误的是
A.①中X2+是还原产物 B.还原性强弱的顺序为:Z->A2+
C.氧化性强弱的顺序为:XO4->B2 D.溶液中可发生:Z2+2A2+====2A3++2Z-
难度: 中等查看答案及解析
-
下列每组中的两种物质相互反应时,无论谁过量,都可以用同一离子方程式表示的是
A.碳酸钠溶液和盐酸 B.明矾溶液和烧碱溶液
C.石灰水和二氧化碳 D.硫酸溶液和氢氧化钡溶液
难度: 简单查看答案及解析
-
下列例子方程式中,错误的是
A.向AlCl3中加入过量氨水: Al3++3NH3·H2O== Al(OH)3↓+3NH4+
B.硫酸氢钠溶液中加入足量的烧碱溶液:H++OH-=== H2O
C.过氧化钠加入水: 2Na2O2+2H2O==4OH-+O2↑+4Na+
D.金属铝溶于氢氧化钠溶液:2Al+2OH-==2AlO2-+H2↑
难度: 中等查看答案及解析
-
硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100 mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成
A.S2- B.S C.SO32- D.SO42-
难度: 中等查看答案及解析
-
镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤,滤液中存在的离子有
A.AlO2- B.Cu2+ C.Al3+ D.Mg2+
难度: 简单查看答案及解析
-
将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A.2:1:1 B.1:1:2 C.1:2:1 D.4:3:1
难度: 困难查看答案及解析
-
把过氧化钠投入含有HCO3-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是
A.HCO3- B.Cl- C.Mg2+ D.Na+
难度: 简单查看答案及解析
-
用1L1mol·L-1NaOH溶液吸收0.6molCO2,所得溶液中Na2CO3和NaHCO3的物质的量之比约为
A、2︰3 B、1︰2 C、2︰1 D、3︰2
难度: 中等查看答案及解析
-
某一反应体系中有反应物和生成物共6种:HCl、H2SO4、SnCl2、SnCl4、FeSO4、Fe2(SO4)3,已知反应前在溶液中滴加KSCN溶液呈血红色,反应后红色消失。则该反应中的氧化剂和氧化产物分别是
A.SnCl4、Fe2(SO4)3 B.Fe2(SO4)3、SnCl4
C.SnCl2、FeSO4、 D.HCl、H2SO4
难度: 中等查看答案及解析
-
甲、乙两烧杯中各盛有100mL 3mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中加入等质量的铝粉,反应结束后生成气体的体积比为甲:乙=1:2,则加入铝粉的质量为
A.1.8g B.3.6g C.2.7g D.5.4g
难度: 困难查看答案及解析
-
下列化学反应的离子方程式书写不正确的是
A.碳酸钙与盐酸的反应: CaCO3 +2H+ = Ca2++ CO2↑+ H2O
B.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合: Mg2++2OH-=Mg(OH)2↓
C.氧化铜与稀H2SO4反应: CuO+2H+ =Cu2+ + H2O
D.金属钠跟水反应: 2Na+2H2O=2Na++ 2OH- + H2↑
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说正确的是
A.高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3NA
B.78g过氧化钠中含阴离子数为2 NA
C.C2H4和N2组成的42g混合气体中原子的个数为3 NA
D.5NH4 NO3
2HNO3 + 4N2↑+ 9H2O反应中,生成28gN2 时,转移的电子数目为3.75NA
难度: 中等查看答案及解析
-
已知Ba(AlO2)2可溶于水。下图表示的是向Al2(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系。则有关叙述不正确的是
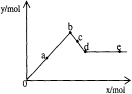
A.0~b段沉淀的物质的量:Al(OH)3始终比BaSO4少
B.c~d段溶液中离子的物质的量:AlO2―比Ba2+多
C.a~d段沉淀的物质的量:BaSO4可能小于Al(OH)3
D.d~e段溶液中离子的物质的量:Ba2+可能等于OH―
难度: 困难查看答案及解析
-
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既不是氧化剂又不是还原剂。下列反应与Cl2+SO2+2H2O=H2SO4+2HCl相比较,水的作用完全相同的是
A.2H2O
2H2↑+O2↑ B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.2Na+2H2O=2NaOH+H2↑ D.2Na2O2+2H2O=4NaOH+O2↑
难度: 中等查看答案及解析
-
下列离子方程式改写成化学方程式正确的是
A.Cu2+ + 2OH- = Cu(OH)2↓ CuSO4+Ba(OH)2= Cu(OH)2↓+ Ba2SO4↓
B.CO32- + 2H+ = CO2↑+ H2O NaHCO3 + HCl =NaCl+ CO2↑+ H2O
C.H+ +OH- = H2O NaOH+HNO3=NaNO3+H2O
D.SO42-+Ba2+=BaSO4↓ BaCl2+H2SO4=BaSO4↓+2HCl
难度: 中等查看答案及解析
-
FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
A.加入KSCN溶液变红色 B.溶液中一定含Fe2+
C.溶液中一定含Cu2+ D.剩余固体中一定含Cu
难度: 中等查看答案及解析
-
下列物质既能跟NaOH溶液作用,又能跟盐酸反应的是
A.NaHCO3 B.Al2O3 C.NaHSO4 D.AlCl3
难度: 简单查看答案及解析
-
向10mL2mol/L的氯化铝溶液中加入0.5mol/L的烧碱溶液,反应得到沉淀0.78g,则加入的烧碱溶液的体积为
A.30mL B.60mL C.90mL D.140mL
难度: 困难查看答案及解析
-
某干燥粉末可能由Na2O.Na2O2.Na2CO3.NaHCO3.NaCl中的一种或几种组成。将该粉末与足量盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温同压下测定)。若将原来的粉末在空气中用酒精灯加热,也有气体放出,且剩余固体的质量大于原混合粉末的质量。下列判断正确的是
A.粉末中一定有Na2O,Na2O2,NaHCO3
B.无法确定是否含有NaHCO3
C.粉末中一定不含有Na2O和NaCl
D.无法确定是否含有Na2CO3和NaCl
难度: 困难查看答案及解析
-
(6分)将少量的铁粉溶于过量的稀硫酸所得的溶液分为三份,在一份溶液里滴加少量的双氧水;在第二份里滴加少量的高锰酸钾溶液;把第三份溶液露置在空气中一段时间,结果这三份溶液都可以使硫氰化钾溶液变红。试写出这三份溶液里发生反应的离子方程式。
(1)
(2)
(3)
难度: 中等查看答案及解析