-
下列说法正确的是
A.天然纤维和化学纤维(简称化纤,包括人造纤维和合成纤维)的主要成分都是纤维素
B.0.2mol/L盐酸与0.05mol/LBa(OH)2溶液等体积混合后,溶液PH为1
C.C60属于原子晶体,用于制造纳米材料
D.氨基酸在固态时主要以内盐的形式存在,属于离子晶体,熔点较高,不易挥发,易溶于水,难溶于有机溶剂
难度: 简单查看答案及解析
-
下列说法正确的是
A.HCHO溶液、(NH4)2SO4溶液均能使蛋白质变性
B.煤的干馏是化学变化,煤的气化和液化是物理变化
C.锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去
D.棉、麻、丝、毛及合成纤维完全燃烧都是只生成CO2和H2O
难度: 简单查看答案及解析
-
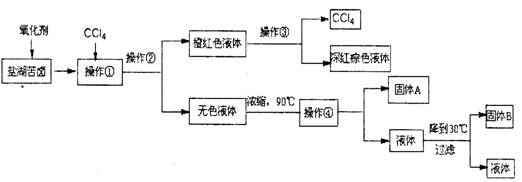
被称为“海洋元素”的溴,其工业制法是把海水浓缩后,通入氯气把溴置换出来,然后用一种气体M把溴吹出来,M最可能是
A.乙烯 B.空气 C.氦气 D.CO2
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1∶1
B.标准状况下,2.24 L 乙醛完全燃烧所得CO2分子数约为0.2NA
C.标准状况下,22.4L氖气中含有NA个氖原子
D.1mol 甲基所含电子数约为8NA
难度: 简单查看答案及解析
-
现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为
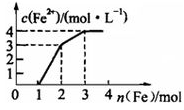
A.1∶1∶3 B.1∶2∶4 C.1∶1∶4 D. 1∶3∶1
难度: 简单查看答案及解析
-
有四组同族元素的物质,在101.3KPa时测定它们的沸点(0C)如下表所示:
第一组
He -268.8
(a) -249.5
Ar -185.8
Kr -151.7
第二组
F2 -187.0
Cl2 -33.6
(b) 58.7
I2 184.0
第三组
(c) 19.4
HCl -84.0
HBr -67.0
HI -35.3
第四组
H2O 100.0
H2S -60.2
(d) -42.0
H2Te -1.8
下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表示氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为c分子量最大
D.第四组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
难度: 简单查看答案及解析
-
下列说法正确的是
A.提取溶解在水中的少量碘,加入酒精震荡、静置,分层后取出有机层再分离。
B.牙膏中的甘油可用Cu(OH)2检验,可根据是否有绛蓝色沉淀生成来判断
C.将一定浓度的NaNO3和KCl混合液加热浓缩、冷却结晶至有晶体析出,可分离出NaCl晶体
D.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象
难度: 简单查看答案及解析
-
美国科学家宣布发现了铝的“超级原子”结构——Al13和Al14,已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态,下列说法中,正确的是
A. Al14与氢碘酸反应的化学方程式可表示为:Al14+2HI= Al14I2+H2↑
B. Al13和Al14互为同位素
C. Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
D. Al13超原子中Al原子间通过离子键结合
难度: 简单查看答案及解析
-
M与
是同分异构体,且满足①能与银氨溶液反应;②1mol有机物在一定条件下能与2molNaOH溶液反应,M可能的结构有
A.4种 B.7种 C.13种 D.16种
难度: 简单查看答案及解析
-
在含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的氧化钠固体,在空气中充分搅拌后再加过了的稀盐酸,溶液中离子浓度变化最小的是
A.Fe3+ B. Al3+ C. Fe2+ D.Na+
难度: 简单查看答案及解析
-
有①②③三瓶体积相等,浓度都是1mol/L的HCl溶液,将①加热蒸发至体积减小一半,在②中加少量CH3COONa固体(加入后溶液仍呈酸性),③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH溶液的体积是
A.①<②=③ B.③>②>① C.①=②=③ D.①=③>②
难度: 简单查看答案及解析
-
已知还原性:SO32->I-,某无色溶液中只可能含有I-、NH4+、Cu2+、SO32-、Na+、Cl-中的某些离子,向该溶液中加入适量溴水,溶液仍然无色,则下列关于溶液组成的判断正确的是①可能含有I- ②肯定含有I- ③可能含有SO32- ④肯定含有SO32- ⑤肯定不含Cu2+ ⑥可能含有Cu2+
A.①③⑥ B.②④⑤ C.①④⑤ D.①③⑤
难度: 简单查看答案及解析
-
下列说法正确的是
A. 常温下,PH=7的CH3COONa和CH3COOH的混合溶液[c(Na+)=0.1mol/L]中各离子浓度关系:c(CH3COOH)>c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
B.0.1mol/LNa2CO3溶液中:c(Na+)>c(CO32-)> c(HCO3-)>c(OH-)
C. 0.1mol/LNaHCO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
D. 向0.2 mol/LNaHCO3溶液中加入等体积的0.1mol/LNaOH溶液:c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
难度: 简单查看答案及解析
-
用氢氧燃料电池(电解质氢氧化钾溶液)电解饱和硫酸钠溶液一段时间,电解时用惰性电极作两级,溶液温度保持不变,下列说法正确的是
A.电解后,c(Na2SO4)增大
B.一段时间后,电解池中溶液pH不变
C.反应后,燃料电池中溶液的PH不变
D.当电池正极消耗2mol气体时,电解池阴极有1mol气体生成
难度: 简单查看答案及解析
-
酸性高锰酸钾能将醇氧化生成一系列产物,反应中KMnO4被还原为Mn2+,用0.60 mol·L-1的酸性高锰酸钾溶液滴定20.0 mL0.50 mol·L-1的乙二醇溶液,当用去20.0 mL高锰酸钾溶液时,再滴加1滴高锰酸钾溶液时,溶液刚好呈紫色,振荡后不褪色。则乙二醇的氧化产物为
A.OHC-CHO B.HOOC-COOH C.HOOC-CHO D.CO2
难度: 简单查看答案及解析
-
某物质可能含有甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种,在鉴定时有下列现象:(1)有银镜反应;(2)加入新制氢氧化铜悬浊液少许,沉淀不溶解;(3)与含酚酞的氢氧化钠溶液共热,红色逐渐消失。下列叙述正确的是
A.四种物质都存在 B.有甲酸乙酯和甲酸
C.有甲酸乙酯和甲醇 D.有甲酸乙酯,可能有甲醇
难度: 简单查看答案及解析
-
足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体4.48L(标准状态),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是60mL。下列说法错误的是
A.混合气体中含NO1.12L B.参加反应的硝酸是0.5mol
C.消耗氧气1.68L D.此反应过程中转移0.6mol的电子
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42-
B.明矾溶液与等物质的量的氢氧化钡溶液混合的离子方程式为:
3Ba2+ +6OH— + 2Al3+ + 3SO42— ═ 3BaSO4↓+ 2Al(OH)3↓
C.向1L0.3mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,则溶液中:
3c(Na+)=2[c(HCO3—)+c(CO32—)+c(H2CO3)]
D.pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO42—)与c(H+)之比约为1:10
难度: 简单查看答案及解析
-
已知W、X、Y、Z四种短周期主族元素在周期表中的相对位置如图所示,下列有关说法正确的是
A.Y的化学活泼性一定比W强
B.Y元素的原子半径可能比X元素的小
C.Z的气态氢化物的稳定性一定比X的强
D.Z的原子序数可能是X的原子序数的2倍
难度: 简单查看答案及解析
-
2011年4月18日沈阳和平区查获“毒豆芽”,其中填加一种动物用药恩诺沙星,其分子结构如图所示,下列有关恩诺沙星说法不正确的是
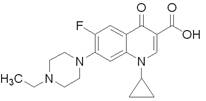
A.本品不溶于水,微溶于甲醇,可溶于酸和碱
B.分子式为C19H22FN3O3
C.该物质能发生酯化、加成、氧化、硝化、缩聚反应
D.该物质的一氯代物共有9种
难度: 简单查看答案及解析
-
在盛有足量A的体积可变的密闭容器中,加入B,发生反应:A(s)+2B(g)
4C(g)+D(g);△H<0。在一定温度、压强下达到平衡。平衡时C的物质的量与加入的B的物质的量的变化关系如下图。下列说法正确的是
A.若保持压强一定,当温度升高后,则图中θ>45°
B.若再加入B,则再次达到平衡时正、逆反应速率均逐渐增大
C.若保持压强一定,再加入B,则反应体系气体密度减小
D.平衡时B的转化率为50%
难度: 简单查看答案及解析
-
今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4 mol·L-1的FeCl3溶液(其它用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变):
组别
①
②
③
④
V[FeCl3(aq)]/mL
100
100
100
100
混合粉末质量/g
6
13.2
24
36
反应后剩余固体质量/g
0
1.28
12.8
24.8
下列结论正确的是
A.第①组反应后溶液中c(Fe3+) = 3.0 mol·L-1
B.第②组剩余固体是铜铁混合物
C.第④组反应后的滤液中c(Fe2+) = 6 mol·L-1
D.原混合粉末中n(Fe)∶n(Cu) = 3∶2
难度: 简单查看答案及解析