-
化学与科学、技术、社会和环境密切相关。下列有关说法中错误的是
A.常温下,反应 C(s) + CO2(g) = 2CO(g)不能自发进行,则该反应的△H > 0
B.合成氨反应 N2(g) + 3H2(g)
2NH3(g) △H < 0,加入催化剂能加快化学反应速率并提高转化率
C.甲烷和乙醇的燃烧热分别是 891.0 kJ/mol、1366.8 kJ/mol,利用甲烷更“低碳”
D.氢氧燃料电池发电,比氢气直接在空气中燃烧发电能量转化率高
难度: 简单查看答案及解析
-
设 NA 表示阿伏加德罗常数的值,下列叙述正确的是
A.在反应 KClO3 + 6HCl = KCl + 3Cl2↑+ 3H2O 中,Cl2 既是氧化产物又是还原产物,当得到标准状况下的 67.2 L Cl2 时,反应中转移的电子数为 5NA
B.标准状况下,22.4 L 甲苯中含有的 C—H 键数目为 8NA
C.50 g 46%的乙醇水溶液中,含氢原子总数目为 3NA
D.t℃时,MgCO3 的 Ksp = 4×10-6,则该温度下饱和 MgCO3 溶液中含有的 Mg2+数目为 2×10-3NA
难度: 简单查看答案及解析
-
下列装置合理且能达到实验目的的是
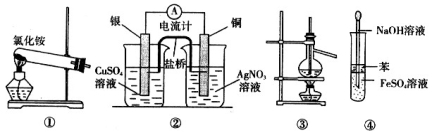
A.实验室用装置①制取氨气
B.装置②将化学能转化为电能
C.装置③可用于分离沸点相差较大的互溶液体混合物
D.装置④可用于 Fe(OH)2 的制取,并能防止 Fe(OH)2 被氧化
难度: 中等查看答案及解析
-
下列离子方程式,书写正确的是
A.用惰性电极电解熔融氯化钠:2Cl-+ 2H2O
Cl2↑+ H2↑+ 2OH-
B.铁粉溶于稀硫酸:2Fe + 6H+ = 2Fe3+ + 3H2↑
C.用 CuSO4 溶液吸收 H2S:Cu2+ + H2S = CuS↓+ 2H+
D.向 NH4HSO4 溶液中滴加少量的 Ba(OH)2 溶液:NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3•H2O+H2O
难度: 中等查看答案及解析
-
在 700℃时,向容积为 2 L 的密闭容器中充入一定量的 CO 和 H2O,发生反应:CO(g) + H2O(g)
CO2(g)+ H2(g),反应过程中测定的部分数据见下表(表中 t2 > t1)。
反应时间/min
n(CO)/mol
n(H2O)/mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法中正确的是
A.反应在 t1 min 内的平均反应速率为υ(CO2) =
mol/(L·min)
B.到 t1 min 时,反应未达到平衡状态
C.温度升至 800℃时,上述反应的平衡常数为 0.64,则正反应为放热反应
D.保持 700℃不变,向平衡体系中再通入 0.60 mol CO 和 0.30 mol H2O,达到新的平衡,与原平衡相比,CO的转化率增大,H2 的体积分数增大
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.向 0.1 mol/L CH3COOH 溶液中加入少量水 ,溶液中
减小
B.将CH3COONa溶液从25℃升温至 40℃,溶液中
增大
C.向硝酸中加入氨水至中性,溶液中
<1
D.向AgCl、AgBr 的饱和溶液中加入少量 AgNO3,溶液中
不变
难度: 困难查看答案及解析
-
在 500 mL KNO3 和 Cu(NO3)2 的混合溶液中,c(NO3-) = 6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到 22.4 L 气体(标准状况),假定电解后溶液体积仍为 500 mL,下列说法正确的是
A.电解得到的 Cu 的物质的量为 0.5 mol
B.向电解后的溶液中加入 98 g 的 Cu(OH)2 可恢复为原溶液
C.原混合溶液中 c(K+) = 4 mol/L
D.电解后溶液中 c(H+) = 2 mol/L
难度: 简单查看答案及解析


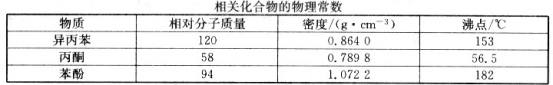

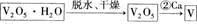
 则 V 原子的配位数是
则 V 原子的配位数是


 的同分异构体的结构简式:____________(写出 2 种)。
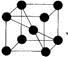
的同分异构体的结构简式:____________(写出 2 种)。 ,请设计合成路线,要求不超过 4 步(无机试剂任选)。 合成路线的书写格式参照如下示例流程图:
,请设计合成路线,要求不超过 4 步(无机试剂任选)。 合成路线的书写格式参照如下示例流程图: 