-
下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.稀醋酸溶液加热时其pH 减小
C.小苏打溶液与AlCl3溶液混合产生气体和沉淀 D.浓的硫化钠溶液有臭味
难度: 中等查看答案及解析
-
有关如下图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)

A.铜片上有气泡逸出
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.反应前后铜片质量不改变
难度: 中等查看答案及解析
-
某混合溶液中所含离子的浓度如下表,则M离子可能为
所含离子
NO3-
SO42-
H+
M
浓度 /(mol·L-1)
2
1
2
1
A.Cl- B.Ba2+ C.Na+ D.Mg2+
难度: 中等查看答案及解析
-
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O ( l ) ΔH=-57.3 kJ / mol
分别向1 L 0.5 mol / L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时反应热分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是
A.ΔH1>ΔH3>ΔH2 B.ΔH1<ΔH2<ΔH3
C.ΔH1=ΔH2=ΔH3 D.ΔH1<ΔH3<ΔH2
难度: 中等查看答案及解析
-
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是

A.2SO2(g)+O2(g)
2SO3(g) ΔH<0
B.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH<0
C.H2(g)+I2(g)
2HI(g) ΔH>0
D.2A(g)+B(s)
2C(g) ΔH>0
难度: 中等查看答案及解析
-
下面是关于中和滴定的实验叙述:取25.00 mL未知浓度的HCl溶液。在横线标明操作中,有错误的是
a.放入锥形瓶中,此瓶需事先用蒸馏水洗净。 b.并将该瓶用待测液润洗过。
c.加入几滴酚酞作指示剂。 d.取一支酸式滴定管,经蒸馏水洗净。
e.直接往其中注入标准NaOH溶液,进行滴定。
f.一旦发现溶液由无色变成粉红色,即停止滴定,记下数据。
A.d、e、f B.b、d、e、f C.b、d、e D.b、c、e、f
难度: 中等查看答案及解析
-
下列叙述中,正确的是
①锌跟稀硫酸反应制取氢气,加入少量CuSO4溶液能提高反应速率 ②镀层破损后,白铁(镀锌的铁)比马口铁(铁锡的铁)更易腐蚀; ③电镀时应把镀件置于电解槽的阴极 ;④冶炼铝时,把氧化铝加热成为熔融体后电解 ⑤钢铁表面常易腐蚀生成Fe2O3·nH2O
A.①②③④⑤ B.①③④⑤ C.①③⑤ D.②④
难度: 中等查看答案及解析
-
下列液体均处于25℃,有关叙述不正确的是
A.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
B.某物质的溶液中由水电离的c(H+)=1×l0-12mol·L-1,则该物质一定是强碱溶液
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度不相同
D.pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+) < c(CH3COO-)
难度: 中等查看答案及解析
-
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
难度: 中等查看答案及解析
-
在密闭容器中,对于可逆反应A+3B
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是

A.若正反应方向ΔH<0,则T1>T2
B.压强增大时,混合气体的平均相对分子质量减小
C.B一定为气体
D.A一定为气体
难度: 中等查看答案及解析
-
下列各选项中所述的两个量,前者一定大于后者的是
A.1 L 0.3 mol·L-1 CH3COOH溶液和3 L 0.1 mol·L-1 CH3COOH溶液中的H+数
B.纯水在25℃和80℃时的pH
C.在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数
D.相同条件下,H2分别与Cl2、F2反应的反应速率
难度: 中等查看答案及解析
-
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
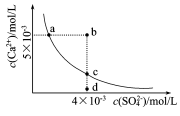
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成
D. 向d点溶液中加入适量CaCl2固体可以变到c点
难度: 中等查看答案及解析
-
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶掖等体积混合后,下列关系式中正确的是
A.c (Na+)=c(CH3COO-)+c(CH3COOH)
B.c(H+)=c(CH3COO-)+c(OH一)
C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+)
D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI + 3H2O
KIO3 + 3H2↑。下列有关说法正确的是
A.电解时,石墨作阴极,不锈钢作阳极
B.电解时,阳极反应是:I –-6e –+ 3H2O = IO3 – + 6H+
C.在KI溶液溶液中加入酚酞,电解时阳极区变红色
D.电解时溶液中I –向阴极迁移
难度: 中等查看答案及解析
-
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:
FePO4+Li
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。
下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性 B.放电时Li+向负极移动
C.充电过程中,电池正极材料的质量减少 D.放电时电池正极反应为:Li-e-=== Li+
难度: 中等查看答案及解析
-
下列分子中,各原子均处于同一平面上的是
A.NH3 B.CCl4 C.SO32- D.CH2O
难度: 中等查看答案及解析
-
能用键能知识解释的是
A.稀有气体的化学性质很不活泼 B.HCl气体比HI气体稳定
C.干冰易升华 D.HF熔沸点高于HCl
难度: 中等查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子的杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强
D.氨气分子是极性分子而甲烷是非极性分子
难度: 中等查看答案及解析
-
膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体。它的分子构型是
三角锥形。以下关于PH3的叙述正确的是
A.PH3分子中有未成键的孤对电子 B.PH3是非极性分子
C.PH3是一种强氧化剂 D.PH3分子的P-H键是非极性键
难度: 中等查看答案及解析
-
三氟化氮(NF3)是一种无色无味的气体,它是氨(NH3)和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F 。下列有关NF3的叙述正确的是
A.NF3是离子化合物 B.NF3分子构型是平面三角形
C.NF3的氧化性比F2强 D.NF3中的N呈+3价
难度: 中等查看答案及解析
-
下列有机物的命名正确的是
A. 1,2─二甲基戊烷 B. 2─乙基戊烷 C. 3,4─二甲基戊烷 D. 3─甲基己烷
难度: 中等查看答案及解析
-
有八种物质:①甲烷、②苯、③聚乙烯、④聚异戊二烯、⑤2-丁炔、⑥环己烷、⑦邻二甲苯、
⑧环己烯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是
A.③④⑤⑧ B.④⑤⑧ C.④⑤⑦⑧ D.③④⑤⑦⑧
难度: 中等查看答案及解析
-
DDT是人类合成得到的第一种有机农药,它的结构简式如下图所示,有关它的说法正确的是
A.它属于芳香烃
B.分子式为C14H8Cl5
C.1mol该物质能与6mol H2加成
D.分子中最多可能有27个原子共面
难度: 中等查看答案及解析
-
1-溴丙烷和2-溴丙烷分别与氢氧化钠醇溶液共热的反应中,两反应
A.产物相同,反应类型相同 B.碳氢键断裂的位置相同
C.产物不同,反应类型不同 D.碳溴键断裂的位置相同
难度: 中等查看答案及解析
-
分子式为C3H6Cl2的有机物,发生一元氯代反应后,可以生成两种同分异构体,则该C3H6Cl2的名称是
A.1,2-二氯丙烷 B.1,1-二氯丙烷 C.2,2-二氯丙烷 D.1,3-二氯丙烷
难度: 中等查看答案及解析


