-
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol•L-1,则此溶液最多可溶解铁粉的质量为( )
A.11.2g
B.16.8g
C.19.6g
D.22.4g难度: 中等查看答案及解析
-
下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是( )
A.Ca2+、Fe2+、NO3-、Cl-
B.Ba2+、Na+、I-、NO3-
C.Na+、K+、SO42-、SO32-
D.K+、Mg2+、HCO3-、PO43-难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.金属钠与水反应:Na+2H2O=Na++2OH-+H2↑
B.Ag2S沉淀溶解平衡表达式:Ag2S⇌2Ag++S2-
C.Fe3O4与稀硝酸溶液反应:2Fe3O4+18H+=6Fe3++H2↑+8H2O
D.NaHCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.将苯加入浓溴水中,溴水褪色,是因为发生了取代反应
B.除去乙酸乙酯中的少量乙酸,可用氢氧化钠溶液充分反应后再分液
C.水煤气、焦炉气、沼气、汽油等都是混合物,而高分子化合物PVC是纯净物
D.采用银作催化剂由乙烯制备环氧乙烷,其原子利用率为100%,符合化学原子经济性要求难度: 中等查看答案及解析
-
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.20g重水(2H2O)含有10NA个电子
B.常温常压下,1摩氦气含有2NA个原子
C.100mL 1mol/L NaHCO3溶液含有0.1NA个HCO3-
D.5.6g金属铁与足量稀盐酸反应完全反应时,失去0.3NA个电子难度: 中等查看答案及解析
-
关于下列装置说法正确的是( )
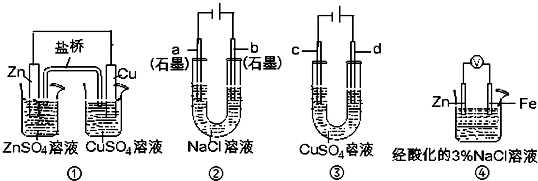
A.用装置③精炼铜时,c极为粗铜
B.装置①中,盐桥中的K+移向ZnSO4溶液
C.装置②工作一段时间后,a极附近溶液的pH增大
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成难度: 中等查看答案及解析
-
下列实验操作不能达到其对应目的是( )
编号 实验操作 目 的 A 取4g NaOH加入96mL水中(水的密度近似看作1g/cm3) 配制4% NaOH溶液 B 配制摩尔溶液实验中,用蒸馏水润洗容量瓶 避免造成误差使配制溶液浓度偏低 C 向CH3COONa溶液中滴入酚酞溶液,加热 证明升高温度能促进CH3COONa水解 D 向盛有铜片的试管中加入浓硫酸,加热 证明浓硫酸具有强氧化性
A.A
B.B
C.C
D.D难度: 中等查看答案及解析