-
白铁皮在发生析氢腐蚀时有0.2mol电子转移,下列说法正确的是( )
A. 有5.6 g金属被腐蚀
B. 有6.5 g金属被氧化
C. 有0.15 mol金属失去电子
D. 标准状况下有4.48 L H2逸出
难度: 中等查看答案及解析
-
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型如图。下列关于水的说法正确的是

A. 水是弱电解质 B. 可燃冰是可以燃烧的水
C. 氢氧两种元素只能组成水 D. 0℃时冰的密度比液态水的密度大
难度: 中等查看答案及解析
-
化合物A在一定条件下发生分解反应,反应物浓度随反应时间的变化如图所示。则化合物A在4~8min间的平均反应速率为( )
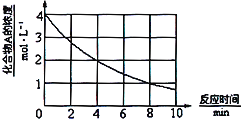
A.0.20mol·L-1·min-l B.0.25mol·L-1·min-l
C.0.30mol·L-1·min-l D.0.50mol·L-1·min-l
难度: 中等查看答案及解析
-
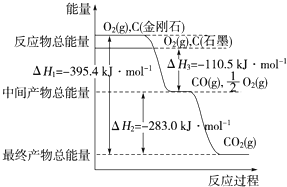
下列说法正确的是( )
A. 已知:H2(g)+
O2(g)═H2O(l);△H=﹣285.8 kJ•mol﹣1 , 则H2的燃烧热为﹣285.8 kJ•mol﹣1
B. 已知:S(g)+O2(g)═SO2(g)△H1=﹣Q1;S(s)+O2(g)═SO2(g)△H2=﹣Q2 , 则Q1<Q2
C. 已知:
H2SO4(浓)+NaOH(aq)═
Na2SO4(aq)+H2O(l)△H1;CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2 , 则有|△H1|<|△H2|
D. 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol﹣1
CO(g)+
O2(g)═CO2(g)△H=﹣283.0 kJ•mol﹣1
C(石墨)+O2(g)═CO2(g)△H=﹣393.5 kJ•mol﹣1
则4Fe(s)+3O2(g)═2Fe2O3(s)△H=﹣1641.0 kJ•mol﹣1
难度: 中等查看答案及解析
-
等体积、等物质的量浓度的NaCl和NaF溶液中,阴阳离子总数相比 ( )
A.前者多 B.后者多 C.一样多 D.无法判断
难度: 中等查看答案及解析
-
下列各组材料中不能组成原电池的是( )
A. 锌片、石墨、硫酸溶液 B. 铜片、银片、氯化铁溶液
C. 锌片、铜片、乙醇溶液 D. 铁片、铜片、稀盐酸
难度: 简单查看答案及解析
-
已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH
HClO
H2CO3
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.4×10-7
Ka2=4.7×10-11
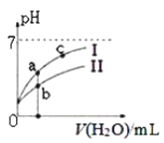
图中表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a、c两点处的溶液中
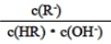 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)D. 图像中a点酸的总浓度大于b点酸的总浓度
难度: 中等查看答案及解析
-
已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
N2+3H2⇌2NH3
起始浓度mol/L
1.0
3.0
0
2秒末浓度mol/L
0.6
1.8
a
A. 0.2mol/(L•s) B. 0.4mol/(L•s) C. 0.6mol/(L•s) D. 0.8mol/(L•s)
难度: 简单查看答案及解析
-
铅蓄电池的总反应式为:PbO2+Pb+2H2SO4
2PbSO4+2H2O据此判断下列叙述正确的是( )
A. 放电时,H2SO4浓度增加
B. 放电时,负极的电极反应式为:Pb+SO42﹣﹣2e﹣═PbSO4
C. 在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸
D. 在充电时,阴极发生的反应是PbSO4﹣2e﹣+2H2O═PbO2+SO42﹣+4H+
难度: 中等查看答案及解析
-
在0.1 mol·L-1NaHCO3与0.1 mol·L-1NaOH等体积混合所得的溶液中,粒子的物质的量浓度关系不正确的是( )
A.c(Na+)>c(CO32-)>c(HCO3-)>c(H2CO3)
B.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
C.c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
难度: 简单查看答案及解析
-
2SO2(g)+ O2(g)
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断正确的是
甲
乙
丙
起始物质的量
n(SO2)/mol
0.4
0.8
0.8
n(O2)/mol
0.24
0.24
0.48
SO2的平衡转化率/%
80
α1
α2
A. 甲中反应的平衡常数小于乙
B. 该温度下,平衡常数值为400
C. 平衡时,丙中c(SO3)是甲中的2倍
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
难度: 中等查看答案及解析
-
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是( )
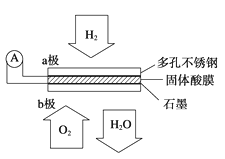
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,便消耗1.12 L的O2
D. H+由a极通过固体酸电解质传递到b极
难度: 中等查看答案及解析
-
700℃时,H2(g)+CO2(g)
H2O(g)+CO(g)。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2和CO2,起始浓度如下表所示。其中甲经2min达平衡时,v (H2O)为0.025 mol/(L·min),下列判断不正确的是( )
起始浓度
甲
乙
丙
C(H2)/mol/L
0.1
0.2
0.2
C(CO2)/mol/L
0.1
0.1
0.2
A. 平衡时,乙中CO2的转化率大于50%
B. 当反应平衡时,丙中c(CO2)是甲中的2倍
C. 温度升至800℃,上述反应平衡常数为25/16,则正反应为吸热反应
D. 其他条件不变,若起始时向容器乙中充入0.10mol/L H2和0.20 mol/L CO2,到达平衡时c (CO)与乙不同
难度: 中等查看答案及解析
-
2015年11月30日第21届联合国气候大会在巴黎召开,会议的一项主题是温室气体减排。如图是科学家正在研发的实现CO2和H2合成甲醇的燃烧电池。下列叙述正确的是
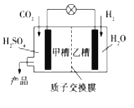
A. 乙槽中反应生成水
B. 甲槽中的电极反应式为:CO2+6e-+5H2O=CH3OH+6OH-
C. 质子从乙槽通过质子交换膜进入甲槽
D. 放电过程中,乙槽的电极附近溶液的pH升高
难度: 中等查看答案及解析
-
室温时,CaCO3在水中的溶解平街曲线如阳所示。已知25℃其浓度积为2.8×10-9mol2/L2,下列说法不正的是( )
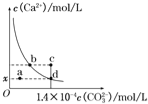
A. x数值为2×10-5 B. c点时有碳酸钙沉淀生成
C. 加入蒸馏水可使溶液由d 点变到a点 D. b点与d对应的的溶度积相等
难度: 中等查看答案及解析
-
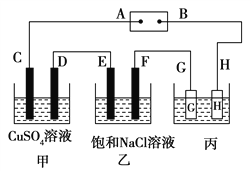
如图是模拟电化学反应装置图。下列说法正确的是( )
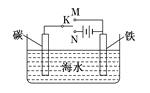
A. 开关K置于N处,则铁电极的电极反应式为:Fe-2e-=Fe2+
B. 开关K置于N处,可以减缓铁的腐蚀
C. 开关K置于M处,则铁电极的电极反应式为: 2Cl--2e-=Cl2↑
D. 开关K置于M处,电子从碳棒经开关K流向铁棒
难度: 简单查看答案及解析
-
已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的
平衡常数如表所示
t ℃
700
800
830
1000
1200
K
1.67
1.11
1.00
0.60
0.38
下列有关叙述正确的是( )
A. 该反应的化学方程式是: H2(g)+CO2(g)
CO(g)+H2O(g)
B. 上述反应的正反应是吸热反应
C. 如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,如果此时测得CO2为0.5 mol,则该反应达到平衡状态
D. 某温度下,如果平衡常数符合下列关系式:
=
,则此时温度700℃
难度: 中等查看答案及解析
-
[Fe(CN)6]3−可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4−。工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理。下列说法不正确的是
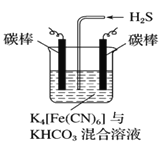
A. 电解时阳极反应式为[Fe(CN)6]4−−e−
[Fe(CN)6]3−
B. 电解时阴极反应式为2HCO3-+2e−
H2↑+2CO32-
C. 当电解过程中有22.4 L标准状况下的H2生成时,溶液中有32 g S析出(溶解忽略不计)
D. 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3
难度: 困难查看答案及解析
-
可逆反应:2NO2
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时,生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
难度: 困难查看答案及解析
-
镍氢电池具有性能好、寿命长等优点,其反应原理是NiO(OH)+ MH==NiO+M + H2O,MH可理解为储氢合金M中吸收结合氢原子,下列说法不正确的是
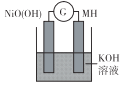
A. MH电极是负极
B. OH-向MH极移动
C. 正极电极反应式:NiO(OH)+e-=NiO+OH-
D. 电子从MH电极流向NiO(OH)电极,经KOH溶液流回MH极
难度: 中等查看答案及解析
-
已知部分弱酸的电离平衡常数如下表:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数(25℃)
Ka=1.75×10-5
Ka=2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11Ka1=1.54×10-2
Ka2=1.02×10-7下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO
+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO
=SO
+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
难度: 困难查看答案及解析
-
标准状态下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O和O===O键的键焓ΔH分别为436 kJ·mol-1、463 kJ·mol-1和495 kJ·mol-1。下列热化学方程式正确的是
A. H2O(g)===H2+1/2O2(g)ΔH=-485 kJ·mol-1
B. H2O(g)===H2(g)+1/2O2(g) ΔH=+485 kJ·mol-1
C. 2H2(g)+O2(g)===2H2O(g) ΔH=+485 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(g) ΔH=-485 kJ·mol-1
难度: 中等查看答案及解析
-
常温下,下列有关叙述正确的是 ( )
A. 0.1 mol·L-1醋酸溶液加水稀释后,各离子浓度均减小
B. pH=7的NH4Cl和氨水混合溶液中,c(NH+4)=c(Cl—)
C. 加热滴有酚酞的CH3COONa溶液,溶液颜色变浅
D. 0.1 mol·L-1Na2CO3溶液中,c(HCO—3)>c(OH—)
难度: 中等查看答案及解析
-
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
难度: 简单查看答案及解析
-
分析下图所示的四个原电池装置,其中结论正确的是( )
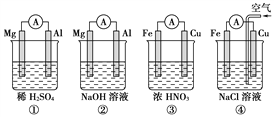
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-===H2↑
难度: 中等查看答案及解析