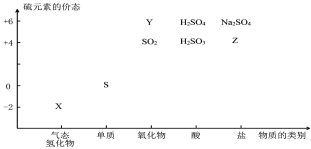
-
是γ放射源,可用于农作物诱变育种,我国用该方法培养出了许多农作物新品种。下列对
原子的叙述中不正确的是
A.质量数是60 B.质子数是60 C.中子数是33 D.电子数是27
难度: 简单查看答案及解析
-
把元素周期表中第16号元素和第6号元素的原子相比较,下列数据中前者是后者的4倍的是
A.电子数 B.最外层电子数 C.中子数 D.次外层电子数
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.熔融状态下硫酸氢钾的电离方程式:KHSO4===K++H++SO42-
B.Cl-的结构示意图:
C.中子数为8的碳原子:
C
D.NaCl的电子式:
难度: 中等查看答案及解析
-
同周期的A、B、C三元素,其最高价氧化物对应水化物的酸性强弱顺序是HAO4>H2BO4>H3CO4,则下列判断错误的是
A.非金属性A>B>C B.气态氢化物稳定性HA>H2B>CH3
C.原子半径A>B>C D.阴离子还原性C3->B2->A-
难度: 中等查看答案及解析
-
无机化学命名委员会(国际组织)在1989年作出规定:把长式周期表原先的主、副族及族号取消,由左到右改为18列,如氢和碱金属元素为第1列,稀有气体元素为第18列。按此规定,下列说法中错误的是
A.第9列元素中没有非金属元素
B.只有第2列元素原子的最外层电子数为2
C.第18列元素的单质在常温常压下均为气体
D.在18列元素中,第3列元素的种类最多
难度: 中等查看答案及解析
-
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是
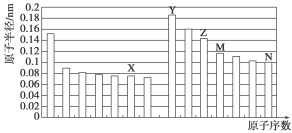
A.Z、N两种元素的离子半径相比,前者较大
B.X、N两种元素的气态氢化物的沸点相比,前者较低
C.由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D.Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
难度: 中等查看答案及解析
-
有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
第一组
He -268.8
(a) -249.5
Ar -185.8
Kr -151.7
第二组
F2 -187.0
Cl2 -33.6
(b) 58.7
I2 184.0
第三组
(c) 19.4
HCl -84.0
HBr -67.0
HI -35.3
第四组
H2O 100.0
H2S -60.2
(d) -42.0
H2Te -1.8
下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第二组物质只表现氧化性,不表现还原性
C.第三组物质中C的沸点最高,是因为C分子内存在氢键
D.第四组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
难度: 中等查看答案及解析
-
根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是
元素代号
A
B
C
D
E
原子半径/nm
0.186
0.143
0.089
0.102
0.074
主要化合价
+1
+3
+2
+6、-2
-2
A.最高价氧化物对应水化物的碱性A>C B.氢化物的沸点H2D>H2E
C.单质与稀盐酸反应的速率A<B D.C2+与A+的核外电子数相等
难度: 中等查看答案及解析
-
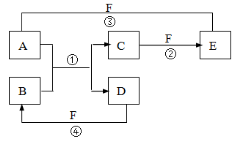
A、B、C三种短周期元素在元素周期表中的相对位置如图所示,已知A、C可分别与B形成化合物X和Y,A与B的质子数之和为C的质子数,现有以下说法,其中判断正确的组合是
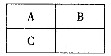
①B与C均存在同素异形体
②X的种类比Y的多
③沸点:A的氢化物小于C的氢化物
④C的最高价氧化物对应水化物能与A的氢化物形成三种盐
A.①②③④ B.②③ C.①②④ D.①④
难度: 中等查看答案及解析
-
有M、X、Y、Z、W五种原子序数依次增大的短周期元素,其中M、Z同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法正确的是
A.X、M两种元素形成的化合物只能存在离子键
B.元素Y、Z、W形成的单质中,每1 mol它们的单质均含有NA个分子
C.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低
D.元素W和M的某些单质可作为水处理中的消毒剂
难度: 中等查看答案及解析
-
元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是
①原子序数:A>B ②离子半径:aAm+<bBn- ③原子半径:A<B ④元素所在的周期数:A>B ⑤A的最高正价与B的最低负价的绝对值相等 ⑥b=a+m-n
A.②③④ B.①②④ C.④⑤⑥ D.②⑤⑥
难度: 中等查看答案及解析
-
下列关于物质结构、性质的说法正确的是
A.因为酸性:HCl>H2CO3,所以非金属性:Cl>C
B.同一周期元素的原子,半径越小越容易失去电子
C.K的原子半径比Na的原子半径大,K与水反应比Na与水反应更剧烈
D.离子化合物中可能含有共价键,共价化合物中可能含有离子键
难度: 中等查看答案及解析
-
将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的总能量高于铁粉和硫粉的总能量
难度: 中等查看答案及解析
-
已知
(l)
=H2O(g) △H1=a kJ·
(2)
=2H2O(g) △H2=b kJ·
(3)
=H2O(l) △H3=c kJ·
(4)
=2H2O(l) △H4=d kJ·
下列关系式中正确的是
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
难度: 中等查看答案及解析
-
飞机用铝粉与高氯酸铵(NH4ClO4)的混合物作固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其方程式可表示为:2NH4ClO4
N2↑+4H2O+Cl2↑+2O2↑+Q,下列对此反应的叙述中错误的是
A.上述反应属于分解反应
B.上述反应瞬间产生大量高温气体推动航天飞机飞行
C.反应从能量变化上说,主要是化学能转变为热能和动能
D.在反应中高氯酸铵只起氧化剂作用
难度: 中等查看答案及解析