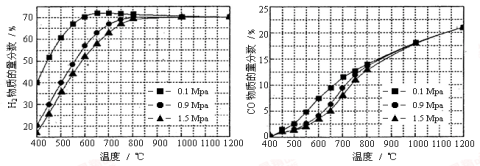
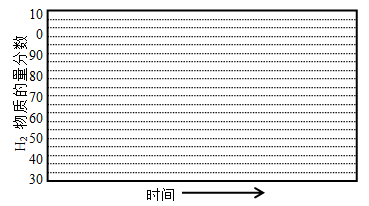
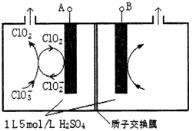
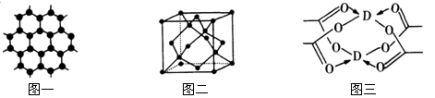
-
下列说法正确的是
A.为了防止中秋月饼的富脂食物因被氧化而变质,常在包装袋里放还原铁粉
B.天然植物油常温下一般呈液态,难溶于水,有固定的熔点、沸点
C.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
D.若两种二肽互为同分异构体,则二者的水解产物一定不相同
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.1L0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA
B.3molFe在足量的水蒸气中完全反应转移9NA个电子
C.2.0gH218O与D2O的混合物中所含中子数为NA
D.1molNa2CO3晶体中含离子总数大于3NA
难度: 简单查看答案及解析
-
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数
之和为24。则下列判断正确的是
A.气态氢化物稳定性:Y>T
B.R能分别与X、Z形成共价化合物
C.R位于元素周期表中第二周期第VA族
D.Z元素的最高价氧化物对应的水化物的化学式为HZO4
难度: 简单查看答案及解析
-
下列有机物同分异构体数目判断错误的是
选项
有机物
同分异构体数目
A
分子式为C5H12
3
B
分子式为C5H10且能使溴的四氯化碳溶液褪色
5
C
分子式为C4H10O且能与Na反应生成氢气
4
D
分子式为C4H8O2且能与NaHCO3反应
3
难度: 简单查看答案及解析
-
利用如图所示装置进行下列实验,不能得出相应实验结论的是
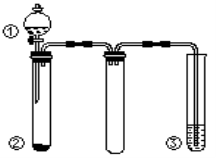
选项
①
②
③
实验结论
A
浓硝酸
Fe
NaOH溶液
说明铁和浓硝酸反应可生成NO2
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀硫酸
Na2CO3
Na2SiO3溶液
非金属性:S>C>Si
D
浓氨水
生石灰
酚酞
氨气的水溶液呈碱性
难度: 简单查看答案及解析
-
下列说法正确的是
A.合成氨时,其他条件不变升高温度,反应速率v(H2)和氢气的平衡转化率均增大
B.3C(s)+ CaO(s)=CaC2(s)+ CO(g)在常温下不能自发进行,说明该反应的△H>0
C.向氨水中不断通入CO2,随着CO2的增加,
 不断增大
不断增大D.铁表面镀铜时,铁与电源的正极相连,铜与电源的负极相连
难度: 简单查看答案及解析
-
某溶液除水电离出的OH﹣、H+之外仅含Fe2+、Na+、Al3+、Ba2+、NO3-、SO42-、Cl﹣中的4种,这4种离子的物质的量均为0.1mol.若向该溶液中加入少量稀硫酸,无沉淀生成但有气泡产生.下列说法错误的是
A.该溶液中肯定不含Ba2+
B.该溶液中除H+、0H﹣之外所含离子是Fe2+、Na+、NO3-、SO42-
C.若向该溶液中加入过量的稀硫酸,溶液中的阴离子会减少一种
D.若向该溶液中加入足量NaOH溶液,滤出沉淀,洗净灼烧后最多能得8.0g 固体
难度: 中等查看答案及解析
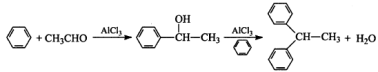
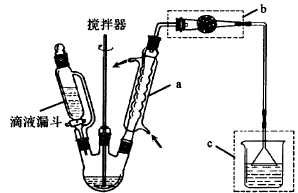

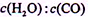 不低于
不低于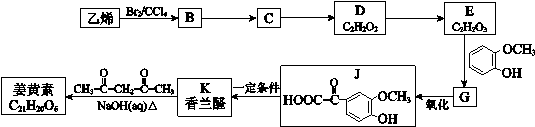
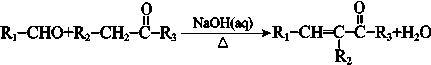 (R1、R2、R3为烃基或氢原子) 请回答:
(R1、R2、R3为烃基或氢原子) 请回答: