-
分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是( )。
A.HClO、HNO3、浓H2SO4都具强氧化性,都是氧化性酸
B.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质
D.HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸
难度: 中等查看答案及解析
-
下图是某燃煤发电厂处理废气的装置示意图。装置内发生的主要反应中不含( )

A.化合反应 B.分解反应
C.置换反应 D.氧化还原反应
难度: 中等查看答案及解析
-
实验室中以下物质的贮存方法不正确的是( )
A.少量液溴可用水封存,防止溴挥发
B.少量金属钠保存在煤油中
C.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
D.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
难度: 中等查看答案及解析
-
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于阴影部分的是( )

A.Cl2+2KBr=Br2+2KCl
B.2NaHCO3
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O=4Fe(OH)3
D.2Na2O2+2CO2=2Na2CO3+O2
难度: 中等查看答案及解析
-
设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
①常温常压下,17 g重甲基(-14CD3)所含的中子数为11NA;
②常温常压下,22.4 L NO气体的分子数小于NA;
③64 g铜发生氧化还原反应,一定失去2NA个电子;
④室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA;
⑤1 mol铁铝混合物与足量稀盐酸反应时,转移电子数是3 NA;
⑥常温常压下,1 mol氦气含有的核外电子数为4NA;
⑦6.8g熔融的KHSO4中含有的阳离子数为0.05 NA ;
A.①② B.③④⑦ C.②④⑦ D.②⑤⑥
难度: 困难查看答案及解析
-
下列离子方程式正确的是( )
A.NaHSO3溶液中投入过氧化钠粉末:4HSO3- +2Na2O2 = 4SO32- + O2↑ + 4Na+
B.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O==AlO2-+4NH4++2H2O
C.氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
D.将1 mol/L NaAlO2溶液和1.5 mol/L HCl溶液等体积互相均匀混合:
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
难度: 困难查看答案及解析
-
下列过程中,最终的白色沉淀不一定是BaSO4的是( )

难度: 中等查看答案及解析
-
实验用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体经历下列过程,Fe3+在PH=5时已完全沉淀,其分析错误的是( )

A.若要用实验测定所得硫酸铜晶体中结晶水的数目要用到坩埚和坩埚钳。
B.利用Cu(OH)2替代CuO也可调试溶液pH不影响实验结果;
C.洗涤晶体:向滤出晶体的漏斗中加少量水浸没晶体,自然流下,重复2-3次;
D.用18mol/L浓硫酸配制溶解所用4mol/L的稀硫酸,玻璃仪器一般只有3种;
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.饱和氯水中 :NH4+、SO32-、AlO2-、Cl-
C.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
D. c(H+)=1.0×10-13mol/L溶液中:K+、Na+、CH3COO-、Br-
难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O
+O2+xOH— Fe3O4+S4O
+2H2O,
下列说法中,正确的是( )
A.每生成1mol Fe3O4,反应转移的电子总数为3mol ;
B.x=6
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol;
D.Fe2+和S2O32—-都是还原剂;
难度: 中等查看答案及解析
-
下列图象能正确表示相关反应中产物物质的量的变化的是( )
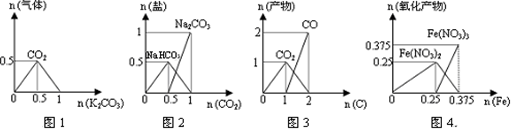
(横、纵坐标单位:mol)
A.图1:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体
B.图2:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐
C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物
D.图4:n(HNO3)=1mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)
难度: 中等查看答案及解析
-
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3 + 2HI = 2FeCl2+ I2 + 2HCl;
2Co(OH)3 + 6HCl = 2CoCl2 + Cl2↑ + 6H2O
2FeCl2 + Cl2 = 2FeCl3
复分解反应: 2CH3COOH + K2CO3 = 2CH3COOK+ CO2 ↑ + H2O;
KCN + CO2 + H2O = HCN + KHCO3
热分解反应: 4NaClO △3NaCl + NaClO4;
NaClO4 △NaCl + 2O2↑
下列说法不正确是( )
A.氧化性(酸性溶液):Co(OH)3 >FeCl3 > I2
B.还原性(酸性溶液):FeCl2 > HI > HCl
C.酸性(水溶液):CH3COOH >H2CO3 >HCN
D.热稳定性:NaCl>NaClO4>NaClO
难度: 中等查看答案及解析
-
要配制浓度约为2 mol/L NaOH溶液100 mL,下面的操作正确的是 ( )
A.用托盘天平称取8 g NaOH固体(NaOH固体放置于天平的托盘上),放入250 mL烧杯中,用100 mL量筒量取100 mL蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B.称取8 g NaOH固体,放入100 mL量筒中,边搅拌边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C.称取8 g NaOH固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D.用100 mL量筒量取40 mL 5 mol/L NaOH溶液,倒入250 mL烧杯中,再用同一量筒量取60 mL蒸馏水,在不断搅拌下慢慢倒入烧杯中
难度: 中等查看答案及解析
-
A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。

则下列说法正确的是( )
A.x与A反应的化学方程式是:

B.检验D溶液中的金属阳离子的反应:Fe3++3SCN—= Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
难度: 中等查看答案及解析
-
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于溶液浓度不同而能发生不同氧化还原反应的是( )
A.①③ B.③④ C.①② D.①④
难度: 中等查看答案及解析
-
某学生想利用如图装置(烧瓶位置不能移动)收集下列气体:
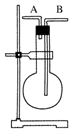
①H2 ②Cl2③CH4④HCl⑤NH3⑥NO⑦NO2⑧SO2,下列操作正确的是 ( )
A.烧瓶是干燥的,由A进气收集①③⑤
B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C.在烧瓶中充满水,由A进气收集①③⑤⑦
D.在烧瓶中充满水,由B进气收集⑥
难度: 中等查看答案及解析
-
类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观实际。下列各说法中正确的是( )
A.根据化合价Fe3O4可表示为FeO·Fe2O3,则Pb3O4也可表示为PbO·Pb2O3
B.CaC2能水【解析】
CaC2+2H2O= Ca(OH)2 +C2H2 ↑,则Al4C3也能水【解析】
Al4C3+12H2O =4A1(OH)3 +3CH4 ↑C.O2与Cu加热生成CuO,则S与Cu加热生成CuS
D.SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀
难度: 中等查看答案及解析
-
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1NaOH溶液450 moL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
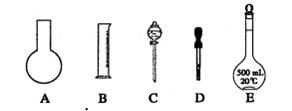
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,烧杯的实际质量为________g。
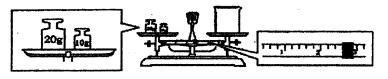
④根据计算得知,所需质量分数为98%、密度为I.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是________。
难度: 中等查看答案及解析
-
一个体重50kg的健康人含铁元素2g。这2g铁以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行Fe2+
Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。
(2)测定绿矾(FeSO4·7H2O)产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为:________。
②判断此滴定实验达到终点的方法是________。
难度: 中等查看答案及解析
-
某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质
Al
Al2O3
Fe
Fe2O3
熔点/℃
660
2054
1535
1462
沸点/℃
2467
2980
2750
-
(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?
答:________(填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为________。
(3)实验室溶解该熔融物,下列试剂中最适宜的试剂是________
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
难度: 中等查看答案及解析
-
向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀总物质的量和加入溶液B的体积关系如图所示:

(1)当加入B溶液110 mL时,溶液中的沉淀是________(填化学式)
(2)将A.B溶液中各溶质的物质的量浓度填入下表:
溶 质
Na2SO4
BaCl2
AlCl3
FeCl3
/mol·L-1
(3)写出滴加B溶液90-100mL时的离子方程式:
________。
难度: 困难查看答案及解析
