-
化学与工农业生产和人类生活密切相关。下列说法中正确的是
A.酸雨就是pH<7的雨水,主要是由大气中的SO2、NO2等造成的
B.饱和氯水既有酸性又有漂白性,加入NaHCO3后漂白性减弱
C.烧融烧碱应选用的器皿是铁坩埚而不是石英坩埚、普通玻璃坩埚或陶瓷坩埚
D.用纯碱制玻璃、用铁矿石炼铁、用氨制碳酸铵都会产生温室气体
难度: 中等查看答案及解析
-
饱和氯水久置后,溶液中的各种粒子:①Cl2 ②ClO- ③Cl- ④HClO ⑤H+ 减小的是
A.①②④ B.①②③ C.①④ D.②④
难度: 中等查看答案及解析
-
下列描述违背化学原理的是
A.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32-
B.将SO2通入酸性高锰钾溶液中,溶液褪色,不能说明SO2具有漂白性
C.高温时碳能置换出二氧化硅中的硅,说明还原性碳比硅强
D.亚硫酸是良好的还原剂,浓H2SO4是良好的氧化剂,但两者混合,却不发生氧化还原反应
难度: 简单查看答案及解析
-
某核素
可形成HmX型氢化物,则 a g HmX 含有
A.
质子 B.
电子
C.
中子 D.
HmX
难度: 中等查看答案及解析
-
元素R有如下反应:RO3-+5R-+6H+===3R2+3H2O,下列说法正确的是
A.元素R位于周期表中第ⅤA族
B.RO3-中的R只能被还原
C.R2在常温常压下一定是气体
D.每反应消耗1 mol RO3-,转移电子的物质的量为5 mol
难度: 简单查看答案及解析
-
对于实验I〜IV的实验现象预测正确的是


A.实验I :逐滴滴加盐酸时,试管中立即产生大量气泡.
B.实验II:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
难度: 中等查看答案及解析
-
将盛有N2和NO2(无N2O4 )混合气体的试管倒立于水中,经过足够长的时间后,试管内气体的体积缩小为原来的一半,则原混合气体中N2和NO2的体积比是
A.1:1 B.1:2 C.1:3 D.3:1
难度: 中等查看答案及解析
-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号
①
②
③
④
⑤
甲
CO2
HCl
CO2
NO2
CO2
乙
SO2
CO2
SO2
SO2
NH3
丙
石灰水
石灰水
Ba(NO3)2
BaCl2
CaCl2
A.②③④ B.①②③④ C.①③④ D.②③④⑤
难度: 中等查看答案及解析
-
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑,A和X反应的转化关系如下图所示,其中反应条件及部分产物均已略去,下列有关说法正确的是

A.X能使蔗糖变黑主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最终一定有白色沉淀产生
D.工业上,B转化为D的反应需使用催化剂
难度: 中等查看答案及解析
-
如图所示各为元素周期表的一部分,表中数字是原子序数,其中X为35的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列实验合理的是
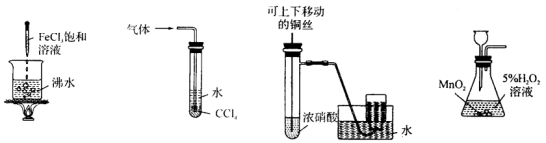
A.得到红褐色沉淀 B.吸收氨气,并防止倒吸
C.制备并收集少量NO2气体 D.实验室制O2
难度: 中等查看答案及解析
-
已知X、Y、Z、E、F五种常见物质含有同一元素M,在一定条件下它们有如下转化关系,Z是NO,下列推断不合理的是
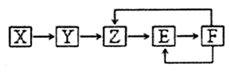
A.X可能是一种氢化物 B.X生成Z一定是化合反应
C.E可能是一种有色气体 D.F中M元素的化合价可能为+5
难度: 困难查看答案及解析
-
在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质:①FeCl3;②Fe2O3;③Cu(NO3)2;④KNO3,铜粉溶解的是
A.只有①或② B.只有②或④
C.只有①或②或③ D.上述四种物质中任意一种
难度: 简单查看答案及解析
-
2007年诺贝尔化学奖授予善于做“表面文章”的德国科学家格哈德·埃特尔。他的成就之一是证实了气体在固体催化剂表面进行的反应,开创了表面化学的方法论。在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示。下列说法正确的是
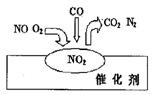
A.NO2是该过程的最终产物
B.NO和O2必须在催化剂表面才能反应
C.汽车尾气的主要污染成分是CO2和NO
D.该催化转化的总反应方程式为:2NO +O2 +4CO
4CO2+N2
难度: 中等查看答案及解析
-
任何科学真理的发现,都不是一帆风顺的,门捷列夫的元素周期表奠定了现代化学和物理学的理论基础。下列关于元素周期表的说法中,不正确的是
A.周期表中的副族、Ⅷ族都是金属元素
B.周期表中的ⅡA族都是金属元素
C.周期表中的非金属元素都位于短周期
D.周期表中的0族元素都是非金属元素
难度: 中等查看答案及解析
-
将11.2 g铜粉和镁粉的混合物分成两等份,其中一份加入200 mL的稀硝酸中并加热,固体和硝酸恰好完全反应,并产生标准状况下的NO2. 24 L;将另一份在空气中充分加热,最后得到mg固体。下列有关说法:①c(HNO3) =2 mol.L-l ②c ( HNO3)=0.5 mol.L-1 ③m=8.0 ④m=7.2 其中正确的是
A.①④ B.①③ C.②④ D.②③
难度: 中等查看答案及解析
-
向100mL FeBr2溶液中通入标况下Cl2 3.36L,Cl2全部被还原,最终测得溶液中c(Br-)是c(Cl-)的一半,则原FeBr2溶液的物质的量浓度(mol•L-1)是
A.0.75 B.1.5 C.2 D.3
难度: 简单查看答案及解析
-
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到的气体其物质的量为a mol,向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1(在相同条件下),则a可能为
A.0.40 B.0.60 C.0.70 D.0.80
难度: 简单查看答案及解析
