-
化学与生产、生活、社会密切相关,下列说法错误的是
A. 中国古代利用明矾溶液淸除铜镜表面的铜锈,是利用了明矾的酸性
B. 碘是人体内必须的微量元素,所以富含高碘酸钾的食物适合所有人群
C. “光化学烟雾”“臭氧空洞”、“硝酸型酸雨”的形成都与氮氧化合物有关
D. 用加入足量氢氧化钠溶液共热的方法可以区分地沟油与矿物油
难度: 中等查看答案及解析
-
含碳、氢、氧三种元素的有机物蒸气密度是CO2的两倍(相同条件下),该有机物中氧原子以“
” 结构存在的同分异构体的数目有
A. 2种 B. 4种 C. 6种 D. 8种
难度: 中等查看答案及解析
-
NA为阿佛加德罗常数的值。下列有关叙述正确的是
A. 107g Fe(OH)3胶体中胶体粒子的数目为NA
B. 1L 0.1 mol•L-1Na2CO3溶液中CO32-和HCO3-离子数之和为0.1 NA
C. 密闭容器中0.5mol H2与0.5mol I2充分反应,得到HI的分子数为NA
D. 30g由14C2H2和C18O组成的混合气体中含有的质子数为14NA
难度: 中等查看答案及解析
-
根据转化关系判断下列说法正确的是

A. 反应②的反应类型属于取代反应
B. (C6H10O5)n可以是淀粉或纤维素,二者互为同分异构体
C. 将烧黑的铜丝趁热插入乙醇中可得到乙酸
D. 向反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯
难度: 中等查看答案及解析
-
下列关于甲、乙、丙、丁四个图像的说法中,不正确的是
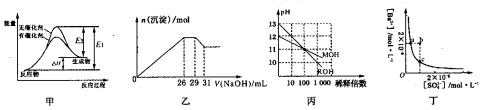
A. 若用甲表示某可逆反应的能量变化,说明催化剂能改变正、逆反应的活化能
B. 图乙表示在含Mg2+、Al3+、NH4+、Cl-的溶液中,加入一定浓度NaOH溶液时生成沉淀的图像,由图可得原溶液中,n(Mg2+):n(Al3+):n(NH4+)=10:2:3
C. 图丙表示MOH和ROH两种一元酸的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
D. 图丁表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
难度: 困难查看答案及解析
-
短周期主族元素,a、b、c、d的原子序数依次增大。四种元素形成的单质依次为m、n、p、q时;x、y、z是这些元素组成的二元化合物,其中z为形成酸雨的主要物质之一;25℃,0.01mol·Lˉ1w溶液中,
。上述物质的转化关系如图所示。下列说法正确的是( )
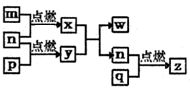
A. 原子半径的大小:a<b<c<d B. 氢化物的沸点:b>d
C. x的电子式为:
D. y、w含有的化学键类型完全相同
难度: 困难查看答案及解析
-
电化学在日常生活中用途广泛,图甲是镁一次氯酸钠热料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理。下列说法正确的是
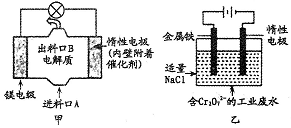
A. 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2
B. 图乙中惰性电极棒上有02放出
C. 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去
D. 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应
难度: 困难查看答案及解析
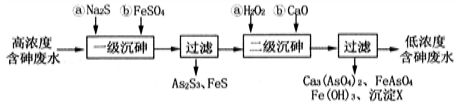
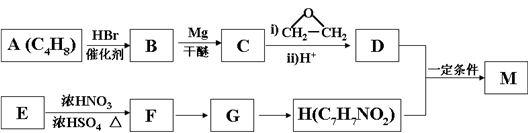
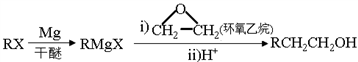 。
。