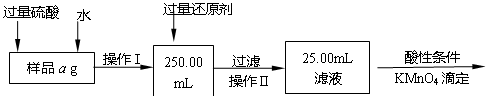
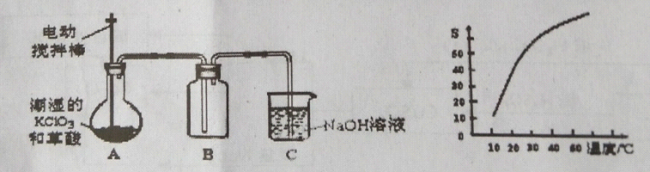
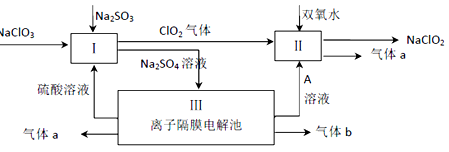
-
黄浦江上游水质污染较为严重,相关自来水厂采用多种方法并用的方式进行水质处理,下列说法中错误的是
A.加活性炭吸附水中小颗粒物,净化水质的方法属于物理方法
B.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
C.用细菌和酶的扩充法去除水中的氨氮的方法属于生物法
D.用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化
难度: 简单查看答案及解析
-
固体NH5属于离子化合物。它与水反应的方程式为:NH5+H2O=NH3·H2O+H2,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
A.与水反应时,水做氧化剂
B.NH5中氮元素的化合价为+5价
C.1molNH5中含有5NA个N-H键
D.与乙醇反应时,NH5被还原
难度: 简单查看答案及解析
-
下列各项内容中,排列顺序正确的是
①固体的热稳定性:Na2CO3>CaCO3>NaHCO3
②物质的熔点Li>Na>K
③微粒半径:K+>S2->F-
④单质的密度Na<K<Rb
⑤氢化物的沸点:H2Se>H2S> H2O
A.①③ B.②④ C.①② D.③⑤
难度: 中等查看答案及解析
-
某学生鉴定甲盐的流程如图所示,下列说法正确的是

A.如果甲中含有硫离子,则乙是硫磺沉淀
B.如果乙是氯化银沉淀,那么甲是氯化铁
C.丙中肯定含有铁离子,所以甲是溴化亚铁
D.甲中含有铁元素,可能显示+2或者+3
难度: 困难查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
二氧化硫和氯水有漂白性
两者都能使溴水褪色
B
硫酸铜可以用做游泳池消毒剂
铜盐能使蛋白质变性
C
盐酸和氨水能溶解氢氧化铝
氢氧化铝是两性氢氧化物
D
用淀粉-碘化钾溶液鉴别氯化亚铁
亚铁离子有氧化性
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M元素最外层电子数与电子层数相等,下列说法不正确的是
Y
Z
M
X
A.原子半径Z<M
B.非金属性:X<Z
C.M元素最高价氧化物对应水化物具有两性
D.Y的最高价氧化物对应的水化物的酸性比X的弱
难度: 中等查看答案及解析
-
下列实验现象预测正确的是

A.实验Ⅰ:振荡后静止,上层溶液颜色保持不变
B.实验Ⅱ:酸性高锰酸钾溶液出现气泡,但颜色无变化
C.实验Ⅲ:微热稀硝酸片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:煮沸溶液至红褐色,停止加热,光束通过体系时产生丁达尔效应
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.向氯化铁溶液中加入氢氧化镁:3Mg(OH)2(s)+2Fe3+(aq)=2Fe(OH)3(s)+3Mg2+(aq)
B.钠与硫酸铜溶液反应:2Na+Cu2+=Cu+2Na+
C.已知:酸的强弱H2CO3>HClO>HCO3-,则:2ClO-+CO2(少量)+H2O=CO32-+2HClO
D.将足量的碳酸氢钠溶液加入少量澄清石灰水中:Ca2++OH-+HCO3-=CaCO3↓+H2O
难度: 困难查看答案及解析
-
用NA表示阿伏伽德罗常数的值,下列叙述正确的是
A.常温常压下,92g的二氧化氮和四氧化二氮的混合气体中含有原子数为6NA
B.惰性电极电解食盐水,若电路中通过NA个电子,则阳极产生气体11.2L
C.0.25mol过氧化钠中含有的阴离子数为0.5NA
D.在KIO3+6HI=KI+3I2+3H2O反应中,每生成3mol碘转移的电子数为6NA
难度: 困难查看答案及解析
-
某溶液中可能含有OH-、CO32- 、AlO2-、 SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+。当向该溶液中加入一定物质的量浓度的盐酸时,发现生成沉淀物质的量随盐酸的体积变化如图所示,下列说法正确的是
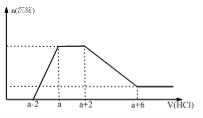
A.原溶液一定含有硫酸钠
B.反应最后形成的溶液中的溶质为氯化钠
C.原溶液中一定含有的阴离子有OH-、CO32- 、AlO2-、 SiO32-
D.原溶液中含有CO32-与AlO2-的物质的量之比为1:1
难度: 困难查看答案及解析
-
稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:①铈常见的化合价为+3和+4价;②氧化性:Ce4+> Ce3+。下列说法正确的是
A.
它们互称同素异形体
B.铈溶于氢碘酸的主要化学方程式可表示为2Ce+6HI=2CeI3+3H2↑
C.工业上可以采用电解氯化铈水溶液来获得铈单质
D.工业上金属铈一般保持在敞口容器中
难度: 困难查看答案及解析
-
向含SO32-、 Fe2+、 Br-、 I- 各0.1摩尔的溶液中通入标准状况下的氯气,通入氯气的体积和溶液中相关离子的物质的量关系图正确的是

难度: 困难查看答案及解析
-
硫酸铜是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是

A.相对于途径①,途径②更好地体现了绿色化学思想
B.Y可以是葡萄糖溶液
C.硫酸铜在1100℃分解所得气体X可能是二氧化硫和三氧化硫的混合气体
D.将硫酸铜溶液蒸发浓缩,冷却结晶可制得胆矾晶体
难度: 困难查看答案及解析
-
将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成氯化钠、次氯酸钠、氯酸钠共存体系。下列判断正确的是
A.与氢氧化钠反应的氯气为0.16mol
B.n(Na+):n(Cl-)可能为7:3
C.若反应中转移的电子为nmol,则0.15<n<0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
难度: 困难查看答案及解析
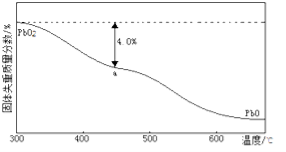
 )的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n
)的残留固体,若a点固体组成表示为PbO2或mPbO2 ·nPbO,计算x值和m:n